Éter etílico
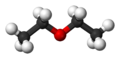
O etoxietano, também conhecido como éter etílico, éter sulfúrico, ou simplesmente éter, tem fórmula molecular C4H10O e fórmula estrutural CH3CH2-O-CH2CH3. É uma substância líquida volátil e altamente inflamável. Utilizado inicialmente como anestésico, foi abandonado pelo risco de explosão. Atualmente serve como ótimo solvente para laboratório e experiências químicas.
O nome éter, aplicado para designar o espaço vazio entre a matéria, foi atribuído a essas substâncias devido à grande volatilidade do éter etílico, também denominado éter sulfúrico,
Embora tivesse sido observado pelos Alquimistas Árabes em pequenas quantidades, teria sido obtido pela primeira vez no século XVI pelo naturalista alemão Valerius Cordus ao tratar spiritus vigni (álcool) com oleum dulce vitrioli (ácido sulfúrico).
Também teria sido preparado pelo Alquimista Alemão Becher, mas ficou esquecido durante muito tempo, e em 1730 foi redescoberto por Frobenius.
O nome éter aplicava-se também aos ésteres, que posteriormente foram chamados éteres-sais, enquanto os éteres propriamente ditos foram chamados éteres-óxidos.
A denominação moderna, "éster" para os éteres-sais foi proposta pelo químico alemão Christian Gottlob Gmelin.
Costuma-se dividir os éteres em duas classes: os simples, ou simétricos, quando os dois grupos ligados ao oxigênio forem iguais; e mistos, ou assimétricos, se forem diferentes.
O éter etilico é a substância líquida mais inflamável conhecida, embora não seja tóxico aos seres humanos, assim podendo ser utilizado em laboratórios sem a necessidade de uso de uma máscara ou outros equipamentos destinados à proteção do indivíduo. Entretanto, é aconselhável a utilização de equipamento de proteção individual devido à sua inflamabilidade.
História
[editar | editar código-fonte]O etoxietano, também conhecido como éter etílico, éter sulfúrico, ou simplesmente éter, tem fórmula molecular C4H10O e fórmula estrutural CH3CH2-O-CH2CH3. É uma substância líquida volátil e altamente inflamável. Utilizado inicialmente como anestésico, foi abandonado pelo risco de explosão. Atualmente serve como ótimo solvente para laboratório e experiências químicas.
O nome éter, aplicado para designar o espaço vazio entre a matéria, foi atribuído a essas substâncias devido à grande volatilidade do éter etílico, também denominado éter sulfúrico,
Embora tivesse sido observado pelos Alquimistas Árabes em pequenas quantidades, teria sido obtido pela primeira vez no século XVI pelo naturalista alemão Valerius Cordus ao tratar spiritus vigni (álcool) com oleum dulce vitrioli (ácido sulfúrico).
Também teria sido preparado pelo Alquimista Alemão Becher, mas ficou esquecido durante muito tempo, e em 1730 foi redescoberto por Frobenius.
O nome éter aplicava-se também aos ésteres, que posteriormente foram chamados éteres-sais, enquanto os éteres propriamente ditos foram chamados éteres-óxidos.
A denominação moderna, "éster" para os éteres-sais foi proposta pelo químico alemão Christian Gottlob Gmelin.
Costuma-se dividir os éteres em duas classes: os simples, ou simétricos, quando os dois grupos ligados ao oxigênio forem iguais; e mistos, ou assimétricos, se forem diferentes.
Antigamente, o éter era produzido pelo aquecimento do álcool etílico com ácido sulfúrico concentrado (daí o nome éter sulfúrico).[4]
O químico inglês Alexander William Williamson descobriu uma nova forma de sintetizar éteres, através da reação de etóxidos (veja Etóxido de sódio) com haletos de alquila,[4] a Síntese de Williamson.
Hoje em dia, é produzido pela passagem de vapor de álcool sobre alumina.
Referências
- ↑ a b c d e Registo de CAS RN 60-29-7 na Base de Dados de Substâncias GESTIS do IFA, accessado em 8 de Janeiro de 2008
- ↑ a b Sabine Amslinger, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ Spezifikationen für „Diethylether reinst Ph. Eur.“ beim Hersteller AppliChem, abgerufen am 11. November 2009
- ↑ a b The Composition and Structure of Ether