ARN ribossômico

O ácido ribonucleico ribossómico, ARNr (pt), RNAr (pt-br) ou rRNA (do inglês ribonucleic acid)[1] é o componente primário dos ribossomos, essencial para todas as células. O RNAr é uma ribozima que realiza a síntese de proteínas nos ribossomos. É transcrito a partir do DNA ribossómico (rDNA) e, em seguida, ligado às proteínas ribossomais para formar subunidades ribossômicas pequenas e grandes. O RNAr é a forma predominante de RNA encontrada na maioria das células; representa cerca de 80% do RNA celular, apesar de nunca ser traduzido em proteínas. Os ribossomos são compostos por aproximadamente 60% de RNAr e 40% de proteínas ribossomais em massa.[2]
Estrutura
[editar | editar código-fonte]Embora as sequências nucleotídicas primárias do RNA ribossômico variem consideravelmente entre as espécies, as mesmas partes de cada tipo de RNAr podem se dobrar em uma estrutura tridimensional bastante semelhante, contendo hastes-rígidas pareadas e sítios de ligação para proteínas, RNAm e RNAt.[2]
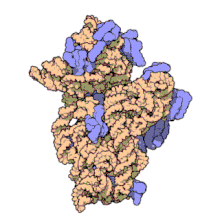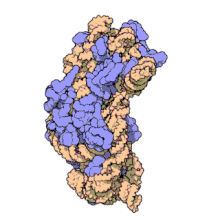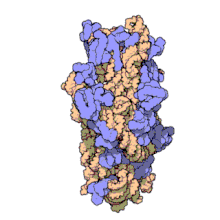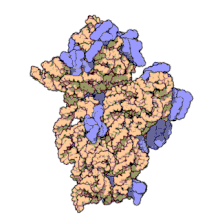
) é mostrado enrolado em laranja com proteínas ribossômicas anexadas em azul.]]
Por causa dessas configurações, o RNAr pode formar interações estreitas e específicas com proteínas ribossômicas, formando as subunidades ribossomais grande e pequena.[3] Estas proteínas ribossomais contêm resíduos básicos (em oposição aos resíduos ácidos) e resíduos aromáticos (isto é, fenilalanina, tirosina e triptofano), permitindo-lhes formar interações químicas com suas regiões de RNA associadas, como interações de empilhamento. As proteínas ribossomais também podem se reticular à estrutura de açúcar-fosfato do RNAr com locais de ligação que consistem em resíduos básicos (isto é, lisina e arginina).[3]
Cada subunidade ribossomal contém RNA ribossomais e proteínas ribossomais específicas; a subunidade 30S contém o RNAr 16S e 21 proteínas, enquanto a subunidade 50S contém os RNArs 5S e 23S, além de 31 proteínas.[4] Todas as proteínas ribossomais (incluindo as sequências específicas que se ligam ao RNAr) foram identificadas. Essas interações, juntamente com a associação das subunidades ribossômicas pequenas e grandes, resultam em um ribossomo funcional capaz de sintetizar proteínas.
Nos ribossomos de procariotos, como bactérias, a subunidade pequena (SSU, do inglês: small subunit) contém uma única molécula pequena de rRNA (~1500 nucleotídeos), enquanto a subunidade grande (LSU, large subunit) contém uma molécula pequena de RNAr e uma molécula grande de RNAr (~3000 nucleotídeos). Estes são combinados com ~50 proteínas ribossômicas para formar subunidades ribossômicas. Existem três tipos de RNAr encontrados nos ribossomos procarióticos: RNAr 23S e 5S no LSU, e RNAr 16S no SSU.[4]
Nos ribossomos de eucariotos, como humanos, são encontrados quatro espécies de RNAr: o SSU contém um único rRNA pequeno (~1800 nucleotídeos), enquanto o LSU contém dois pequenos rRNAs e uma molécula de rRNA grande (~5000 nucleotídeos). O RNAr eucariótico tem mais de 70 proteínas ribossômicas que interagem para formar unidades ribossômicas maiores e mais polimórficas em comparação com procariotos.[5]
As sequências de RNAr são amplamente utilizadas para o estudo das relações evolutivas entre os organismos, uma vez que são de origem antiga,[6] são encontradas em todas as formas de vida conhecidas e são resistentes à transferência horizontal de genes. As sequências de rRNA são conservadas (inalteradas) ao longo do tempo devido ao seu papel crucial na função do ribossomo.[7] A informação filogênica derivada do RNAr 16s é atualmente usada como o principal método de delineamento entre espécies procarióticas semelhantes, calculando a similaridade de nucleotídeos.[4][8]
Algumas moléculas de RNAr apresentam atividade catalítica semelhante as enzimas e são, portanto, ribozimas. A estrutura do RNAr é capaz de mudar drasticamente para afetar a ligação do RNAt ao ribossomo durante a tradução de outros RNAm.[9] No RNAr 16s, isso ocorre quando certos nucleotídeos parecem alternar o emparelhamento de bases entre um nucleotídeo ou outro, formando um "interruptor" que altera a conformação do RNAr. Este processo é capaz de afetar a estrutura do LSU e SSU, sugerindo que esta mudança conformacional na estrutura do rRNA afeta todo o ribossomo em sua capacidade de combinar um códon com seu anticódon na seleção de tRNA, bem como decodificar mRNA.[10]
Montagem
[editar | editar código-fonte]A integração e montagem do RNA ribossomal em ribossomos começa com seu dobramento, modificação, processamento e montagem com proteínas ribossômicas para formar as duas subunidades ribossômicas, a LSU e a SSU. Em procariotos, a incorporação de RNAr ocorre no citoplasma devido à falta de organelas ligadas à membrana. Já em eucariotos, esse processo ocorre principalmente no nucléolo e é iniciado pela síntese de pré-RNA, o que requer a presença de todas as três RNA polimerases. A transcrição do pré-RNA pela RNA polimerase I é responsável por cerca de 60% da transcrição total do RNA celular.[11]
Isso é seguido pelo dobramento do pré-RNA para que ele possa ser montado com as proteínas ribossomais. Este dobramento é catalisado por endo- e exonucleases, RNA helicases, GTPases e ATPases. O RNAr subsequentemente sofre processamento endo e exonucleolítico para remover espaçadores transcritos externos e internos.[12]
O pré-RNA, então, sofre modificações, como a metilação ou pseudo-uridinilação, antes que os fatores de montagem do ribossomo e as proteínas ribossômicas se montem com o pré-RNA para formar partículas pré-ribossômicas. Após passar por mais etapas de maturação e subsequente saída do nucléolo para o citoplasma, essas partículas se combinam para formar os ribossomos.[12] Os resíduos básicos e aromáticos encontrados na estrutura primária do RNAr permitem interações de empilhamento favoráveis e atração por proteínas ribossômicas, criando um efeito de reticulação entre a estrutura do RNAr e outros componentes da unidade ribossômica. Mais detalhes sobre o início e a porção inicial desses processos podem ser encontrados na seção "Biossíntese".
Função
[editar | editar código-fonte]Elementos estruturais secundários universalmente conservados em RNAr entre diferentes espécies mostram que essas sequências são algumas das mais antigas descobertas. Eles desempenham papéis críticos na formação dos sítios catalíticos de tradução do RNAm; nesse processo, as funções do RNAr ligam tanto o RNAm quanto o RNAt para facilitar o processo de tradução da sequência de códons do RNAm em aminoácidos.[13]
O RNAr desempenha papel vital em todos os estágios da síntese proteica, atuando também na associação das subunidades ribossomais, assim como no posicionamento do RNAt nos sítios A e P do ribossomo. Os RNAts também ligam-se ao ribossomo por meio de interações da haste-alça do anticódon do RNAt, com sequências específicas do RNAr 16S, e a extremidade aceptora do RNAt pareia-se com sequências do RNAr 23S.[4]
Em procariotos, o sítio A consiste principalmente em RNAr 16S; no sítio P, por meio da observação de estruturas cristalinas, foi demonstrado que a extremidade 3' do RNAr 16s pode se dobrar no sítio como se uma molécula de RNAm, o que resulta em interações intermoleculares que estabilizam as subunidades. Da mesma forma, como o local A, o local P contém principalmente RNAr com poucas proteínas.[14]
Além disso, a formação de ligações peptídicas é catalisada pelo RNAr. A reação da peptidil transferase, por exemplo, ocorre na subunidade 50S do ribossomo e é catalisada pelo próprio RNAr 23S, em vez de qualquer uma das proteínas ribossomais. Na verdade, estudos têm mostrado que o centro da peptidil transferase não contém proteínas e é inteiramente iniciado pela presença de RNAr.[14] O RNAr 23S também desempenha um papel na translocação, e as proteínas EF interagem especificamente com o RNAr 23S.[4]
Subunidades e RNA ribossômico associado
[editar | editar código-fonte]Tanto os ribossomos procarióticos e eucarióticos podem ser divididos em duas subunidades, uma grande e uma pequena.
Em procariontes, uma pequena subunidade ribossômica 30S contém o RNA ribossômico 16S. A grande subunidade ribossomal 50S contém duas espécies de RNAr (o 5S e o 23S). Portanto, pode-se deduzir que em bactérias e archaeas há genes de RNAr que codificam todos os três tipos de RNAr: 16S, 23S e 5S.[15] Os genes do RNA ribossômico 16S bacteriano, do RNAr 23S e do RNAr 5S são tipicamente organizados como um operon co-transcrito; há um espaçador interno transcrito entre os genes de RNAr 16S e 23S.[16] Pode haver uma ou mais cópias do operon dispersas no genoma (por exemplo, Escherichia coli tem sete). Normalmente em bactérias existem entre uma e quinze cópias.[15]
Em contraste, os eucariotos geralmente apresentam muitas cópias dos genes de RNAr organizados em repetições em tandem. Em humanos, aproximadamente 300-400 repetições estão presentes em cinco grupos, localizados nos cromossomos 13 (RNR1), 14 (RNR2), 15 (RNR3), 21 (RNR4) e 22 (RNR5). Os humanos têm 10 grupos de rDNA genômico que, no total, constituem menos de 0,5% do genoma humano.[17]
Foi previamente aceito que as sequências de rDNA repetidas eram idênticas e serviam como redundâncias ou à prova de falhas para explicar erros de replicação natural e mutações pontuais. No entanto, a variação da sequência no rDNA (e subsequentemente no rRNA) em humanos em vários cromossomos foi observada, tanto dentro como entre indivíduos humanos. Muitas dessas variações são sequências palindrômicas e erros potenciais devido à replicação.[18] Certas variantes também são expressas de maneira específica para tecidos em camundongos.[19]
As células de mamíferos têm 2 moléculas mitocondriais (12S e 16S) de RNAr e 4 tipos de RNAr citoplasmático (as subunidades 28S, 5.8S, 18S e 5S). Os rRNAs 28S, 5.8S e 18S são codificados por uma única unidade de transcrição (45S) separada por 2 espaçadores transcritos internamente. O primeiro espaçador corresponde ao encontrado em bactérias e arqueas, e o outro espaçador é uma inserção no que era o rRNA 23S em procariotos.[16] O rDNA 45S é organizado em 5 grupos (cada um tem 30-40 repetições) nos cromossomos 13, 14, 15, 21 e 22. Estes são transcritos pela RNA polimerase I. O DNA para a subunidade 5S ocorre em matrizes tandem (~200 –300 genes 5S verdadeiros e muitos pseudogenes dispersos), o maior no cromossomo 1q41-42. RNAr 5S é transcrito pela RNA polimerase III. O RNAr 18S na maioria dos eucariotos está na subunidade ribossômica pequena e a subunidade grande contém três espécies de RNAr (5S, 5.8S e 28S em mamíferos, 25S em plantas).
Biossíntese
[editar | editar código-fonte]Em eucariotas
[editar | editar código-fonte]No nucléolo, o RNAr é sintetizado pela RNA polimerase I usando os genes (rDNA) que o codificam, encontrados repetidamente em todo o genoma.
As cópias dos genes que codificam os subtipos 5.8S, 18S e 28S de RNAr estão localizados na região organizadora do nucléolo (RON) e são transcritos em moléculas de RNAr precursor (pré-RNAr). Estas moléculas de pré-RNAr são separadas por sequências espaçadoras externas e internas e então metiladas, o que é fundamental para a montagem e dobragem subsequente. Após a separação e liberação como moléculas individuais, as proteínas de montagem se ligam a cada fita de RNAr e a dobram em sua forma funcional.[20] Após a separação e liberação como moléculas individuais, as proteínas de montagem se ligam a cada fita de RNAr e a dobram em sua forma funcional usando montagem cooperativa e adição progressiva de mais proteínas de dobramento conforme necessário. Os detalhes exatos de como as proteínas de dobramento se ligam ao rRNA e como o dobramento correto é alcançado permanecem desconhecidos.[21]
Os complexos de rRNA são então processados por reações envolvendo clivagens exo- e endo-nucleolíticas guiadas por snoRNA (pequenos RNAs nucleolares) em complexo com proteínas. Como esses complexos são compactados para formar uma unidade coesa, as interações entre o RNAr e as proteínas ribossômicas circundantes são constantemente remodeladas durante a montagem para fornecer estabilidade e proteger os locais de ligação.[22] Esse processo é conhecido como fase de "maturação" do ciclo de vida do RNAr. As modificações que ocorrem durante a maturação do rRNA contribuem diretamente para o controle da expressão gênica, proporcionando regulação física de acesso translacional de RNAt e RNAm.[23] Alguns estudos descobriram que a metilação extensiva de vários tipos de rRNA também é necessária durante esse período para manter a estabilidade do ribossomo.[24]
Os genes que codificam o RNAR 5S (120 nucleotídeos) não estão presentes nos rDNA, ou seja, esses genes estão localizados em outra região do DNA que não a NOR; eles estão localizados dentro do nucléolo e são transcritos em RNAr pré-5S pela RNA polimerase III. O pré-RNAr 5S entra no nucléolo para processamento e montagem com RNAr 28S e 5.8S para formar o LSU. O rRNA 18S forma as SSUs combinando-se com numerosas proteínas ribossomais. Uma vez que ambas as subunidades são montadas, elas são exportadas individualmente para o citoplasma para formar a unidade 80S e iniciar a tradução do RNAm.
O RNA ribossomal não é codificante e nunca é traduzido em proteínas de qualquer tipo: o RNAr é apenas transcrito do rDNA e então amadurecido para uso como um bloco de construção estrutural para ribossomos. O RNAr transcrito é ligado às proteínas ribossômicas para formar as subunidades dos ribossomos e atua como a estrutura física que empurra o mRNA e o tRNA através do ribossomo para processá-los e traduzi-los.
Regulação Eucariótica
[editar | editar código-fonte]A síntese de rRNA é regulada para cima e para baixo para manter a homeostase por uma variedade de processos e interações:
- A quinase AKT promove indiretamente a síntese de RNAr, uma vez que a RNA polimerase I é dependente de AKT.[25]
- Certas ribonucleases angiogênicas, como a angiogenina (Ang), podem translocar e se acumular no nucléolo. Quando a concentração de Ang se torna muito alta, ela pode se ligar à região promotora do rDNA e aumentar desnecessariamente a transcrição do RNAr. Isso pode ser prejudicial ao nucléolo e pode até levar ao câncer.[26]
- Durante os períodos de restrição da glicose celular, a proteína quinase ativada por AMP (AMPK) desestimula os processos metabólicos que consomem energia, mas não são essenciais. Como resultado, é capaz de fosforilar a RNA polimerase I (no local Ser-635) a fim de regular negativamente a síntese de RNAr interrompendo a iniciação da transcrição.
- O comprometimento ou remoção de mais de uma pseudouridina ou regiões de 29-O-metilação do centro de decodificação do ribossomo reduz significativamente a taxa de transcrição de rRNA , reduzindo a taxa de incorporação de novos aminoácidos.[27]
- A formação de heterocromatina é essencial para silenciar a transcrição do rRNA, sem a qual o RNA ribossomal é sintetizado sem verificação e diminui muito a expectativa de vida do organismo.[28]
Ver também
[editar | editar código-fonte]Referências
- ↑ Infopédia. «ARN»
- ↑ a b Lodish, Harvey; Berk, Arnold; Kaiser, Chris A. (2014). Biologia Celular e Molecular 7 ed. Porto Alegre: Artmed Editora. p. 136. ISBN 9788582710500
- ↑ a b Urlaub, H; Kruft, V; Bischof, O; Müller, EC; Wittmann-Liebold, B (1995). «Protein-rRNA binding features and their structural and functional implications in ribosomes as determined by cross-linking studies». The EMBO Journal. 14(18). PMC 394550
 . PMID 7556101. doi:10.1002/j.1460-2075.1995.tb00137.x
. PMID 7556101. doi:10.1002/j.1460-2075.1995.tb00137.x
- ↑ a b c d e Microbiologia de Brock. [S.l.: s.n.]
- ↑ Ferreira-Cerca, Sébastien; Pöll, Gisela; Gleizes, Pierre-Emmanuel; Tschochner, Herbert; Milkereit, Philipp (2005). «Roles of Eukaryotic Ribosomal Proteins in Maturation and Transport of Pre-18S rRNA and Ribosome Function». Molecular Cell. 20 (2): 263-275. ISSN 1097-2765. PMID 16246728. doi:10.1016/j.molcel.2005.09.005. Consultado em 27 de setembro de 2020
- ↑ Woese, Carl R.; Fox, George E. (Novembro de 1977). «Phylogenetic structure of the prokaryotic domain: The primary kingdoms». Proceedings of the National Academy of Sciences. 74(11). PMC 432104
 . PMID 270744. doi:10.1073/pnas.74.11.5088
. PMID 270744. doi:10.1073/pnas.74.11.5088
- ↑ Lagesen, Karin; Hallin, Peter; Rødland, Einar A.; Stærfeldt, Hans-Henrik; Rognes, Torbjørn; Ussery, David W. (1 de maio de 2007). «RNAmmer: consistent and rapid annotation of ribosomal RNA genes» 9 ed. Nucleic Acids Research. 35: 3100–3108. PMC 1888812
 . PMID 17452365. doi:10.1093/nar/gkm160
. PMID 17452365. doi:10.1093/nar/gkm160
- ↑ Chun, J; Lee, JH; Jung, Y; Kim, M; Kim, S; Kim, BK; Lim, YW. «EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal». International Journal of Systematic and Evolutionary Microbiology. 57. PMID 17911292. doi:10.1099/ijs.0.64915-0
- ↑ Lodmell, J. Stephen; Dahlberg, Albert E. (1997). «A Conformational Switch in Escherichia coli 16S Ribosomal RNA During Decoding of Messenger RNA» 5330 ed. Science (em inglês). 277: 1262-1267. doi:10.1126/science.277.5330.1262. Consultado em 27 set 2020
- ↑ Gabashvili, IS; Agrawal, RK; Grassucci, R; Squires, CL; Dahlberg, AE; Frank, J (1999). «Major rearrangements in the 70S ribosomal 3D structure caused by a conformational switch in 16S ribosomal RNA» 22 ed. EMBO J. (em inglês). 277: 6501-6507. PMC 1171713
 . PMID 10562562. doi:10.1093/emboj/18.22.6501. Consultado em 27 de setembro de 2020
. PMID 10562562. doi:10.1093/emboj/18.22.6501. Consultado em 27 de setembro de 2020
- ↑ Woolford, Jr., JL; Baserga†, SJ (2013). «Ribosome Biogenesis in the Yeast Saccharomyces cerevisiae». Genetics. Consultado em 27 de setembro de 2020
- ↑ a b Eukaryotic Ribosome Assembly Jochen Baßler and Ed Hurt Annual Review of Biochemistry 2019 88:1, 281-306
- ↑ Moazed, D; Noller, HF (1987). «"Interaction of antibiotics with functional sites in 16S ribosomal RNA"» 6121 ed. Nature. 327: 389–94. PMID 2953976. doi:10.1038/327389a0
- ↑ a b Moore, PB; Steitz, TA (2002). «"The involvement of RNA in ribosome function"» 6894 ed. Nature. 418: 229–35. PMID 12110899. doi:10.1038/418229a
- ↑ a b Stoddard SF, Smith BJ, Hein R, Roller BR, Schmidt TM (janeiro de 2015). «rrnDB: improved tools for interpreting rRNA gene abundance in bacteria and archaea and a new foundation for future development». Nucleic Acids Research. 43 (Database issue): D593-8. PMC 4383981
 . PMID 25414355. doi:10.1093/nar/gku1201
. PMID 25414355. doi:10.1093/nar/gku1201
- ↑ a b Lafontaine DL, Tollervey D (julho de 2001). «The function and synthesis of ribosomes». Nature Reviews Molecular Cell Biology. 2 (7): 514–20. PMID 11433365. doi:10.1038/35080045. hdl:1842/729
- ↑ Stults DM, Killen MW, Williamson EP, Hourigan JS, Vargas HD, Arnold SM, et al. (dez 2009). «Human rRNA gene clusters are recombinational hotspots in cancer». Cancer Research. 69 (23): 9096–104. PMID 19920195. doi:10.1158/0008-5472.can-09-2680
- ↑ Kim JH, Dilthey AT, Nagaraja R, Lee HS, Koren S, Dudekula D, et al. (julho de 2018). «Variation in human chromosome 21 ribosomal RNA genes characterized by TAR cloning and long-read sequencing». Nucleic Acids Research. 46 (13): 6712–6725. PMC 6061828
 . PMID 29788454. doi:10.1093/nar/gky442
. PMID 29788454. doi:10.1093/nar/gky442
- ↑ Parks MM, Kurylo CM, Dass RA, Bojmar L, Lyden D, Vincent CT, Blanchard SC (Fev 2018). «Variant ribosomal RNA alleles are conserved and exhibit tissue-specific expression». Science Advances. 4 (2): eaao0665. Bibcode:2018SciA....4..665P. PMC 5829973
 . PMID 29503865. doi:10.1126/sciadv.aao0665
. PMID 29503865. doi:10.1126/sciadv.aao0665
- ↑ Zemora G, Waldsich C (November 2010). "RNA folding in living cells". RNA Biology. 7 (6): 634–41. doi:10.4161/rna.7.6.13554. PMC 3073324. PMID 21045541.
- ↑ Dutca LM, Gallagher JE, Baserga SJ (July 2011). "The initial U3 snoRNA:pre-rRNA base pairing interaction required for pre-18S rRNA folding revealed by in vivo chemical probing". Nucleic Acids Research. 39 (12): 5164–80. doi:10.1093/nar/gkr044. PMC 3130255. PMID 21349877.
- ↑ Woodson SA (December 2011). "RNA folding pathways and the self-assembly of ribosomes". Accounts of Chemical Research. 44 (12): 1312–9. doi:10.1021/ar2000474. PMC 4361232. PMID 21714483.
- ↑ Sloan KE, Warda AS, Sharma S, Entian KD, Lafontaine DL, Bohnsack MT (September 2017). "Tuning the ribosome: The influence of rRNA modification on eukaryotic ribosome biogenesis and function". RNA Biology. 14 (9): 1138–1152. doi:10.1080/15476286.2016.1259781. PMC 5699541. PMID 27911188.
- ↑ Gigova A, Duggimpudi S, Pollex T, Schaefer M, Koš M (October 2014). "A cluster of methylations in the domain IV of 25S rRNA is required for ribosome stability". RNA. 20 (10): 1632–44. doi:10.1261/rna.043398.113. PMC 4174444. PMID 25125595
- ↑ Chan JC, Hannan KM, Riddell K, Ng PY, Peck A, Lee RS, et al. (August 2011). "AKT promotes rRNA synthesis and cooperates with c-MYC to stimulate ribosome biogenesis in cancer". Science Signaling. 4 (188): ra56. doi:10.1126/scisignal.2001754. PMID 21878679. S2CID 20979505.
- ↑ Li S, Ibaragi S, Hu GF (May 2011). "Angiogenin as a molecular target for the treatment of prostate cancer". Current Cancer Therapy Reviews. 7 (2): 83–90. doi:10.2174/1573394711107020083. PMC 3131147. PMID 21743803.
- ↑ Liang XH, Liu Q, Fournier MJ (September 2009). "Loss of rRNA modifications in the decoding center of the ribosome impairs translation and strongly delays pre-rRNA processing". RNA. 15 (9): 1716–28. doi:10.1261/rna.1724409. PMC 2743053. PMID 19628622.
- ↑ Larson K, Yan SJ, Tsurumi A, Liu J, Zhou J, Gaur K, et al. (January 2012). "Heterochromatin formation promotes longevity and represses ribosomal RNA synthesis". PLOS Genetics. 8 (1): e1002473. doi:10.1371/journal.pgen.1002473. PMC 3266895. PMID 22291607.
