Carcinoma basocelular
| Carcinoma basocelular | |
|---|---|
| Basalioma facial | |
| Sinónimos | Cancro/Câncer basocelular, cancro/câncer de células basais, Basilioma |
| Especialidade | Dermatologia, oncologia |
| Sintomas | Área de pele ligeiramente elevada e indolor, que se pode apresentar brilhante e com pequenos vasos capilares ou com ulceração.[1] |
| Fatores de risco | pele clara, radiação ultravioleta, radioterapia, arsénico, imunodeficiência[2] |
| Método de diagnóstico | Exame físico, biópsia do tecido[3] |
| Condições semelhantes | Milium, ceratose seborreica, melanoma, psoríase[4] |
| Tratamento | Remoção cirúrgica[2] |
| Prognóstico | Positivo[5] |
| Frequência | ~30% das pessoas brancas (EUA)[2] |
| Mortes | Raras[6] |
| Classificação e recursos externos | |
| CID-10 | C44 (ILDS C44.L21) |
| CID-9 | 173 |
| CID-ICD-O | M8090/3-8093/3 |
| CID-11 | e 1770092375 1203447657 e 1770092375 |
| OMIM | 605462 |
| DiseasesDB | 1264 |
| MedlinePlus | 000824 |
| eMedicine | med/214 |
| MeSH | D002280 |
Carcinoma basocelular ou carcinoma de células basais é o tipo mais comum de cancro da pele.[2] Geralmente manifesta-se na forma de uma área de pele ligeiramente elevada e indolor, que se pode apresentar brilhante e com pequenos vasos capilares ou com ulceração.[1] O carcinoma basocelular é de crescimento lento e pode lesionar os tecidos envolventes, mas é pouco provável que se alastre para áreas distantes ou que seja uma causa de morte.[7]
Entre os fatores de risco estão a exposição a radiação ultravioleta, possuir pele clara, exposição prolongada a arsénico e imunodeficiência.[2] A exposição a radiação ultravioleta durante a infância é particularmente perigosa.[5] As camas de bronzeamento estão-se a tornar outra fonte comum de exposição à radiação UV.[8] O diagnóstico baseia-se geralmente num exame da pele, que pode ser confirmado com uma biópsia do tecido.[2][3]
Não é claro se os protetores solares influenciam o risco de cancro basocelular.[9] O tratamento consiste geralmente na remoção cirúrgica.[2] Quando o carcinoma é pequeno, a remoção pode ser feita com uma simples excisão. Em outros casos é geralmente recomendada a cirurgia de Mohs.[2] Entre outras opções estão a criocirurgia, quimioterapia tópica, cirurgia a laser ou a utilização de imiquimod.[10] Nos casos raros em que ocorrem metástases, pode ser usada quimioterapia ou terapia dirigida.[10]
O carcinoma basocelular é responsável por pelo menos 32% de todos os casos de cancro no mundo.[7][11] Entre os cancros da pele que não melanoma, cerca de 80% são carcinomas basocelulares.[2] Nos Estados Unidos, cerca de 35% dos homens brancos e 25% das mulheres brancas são afetados por um carcinoma basocelular pelo menos uma vez na vida.[2]
Causas
[editar | editar código-fonte]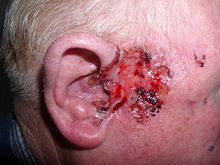
Pode ser causada por mutação do gene embrionário do desenvolvimento folicular SHH (sonic hedgehog) em células germinativas foliculares (tricoblastos)[12] por longos períodos de intensa exposição a radiação solar entre as 10h e 16h, principalmente durante infância e adolescência. Após o dano genético o câncer pode levar dez a cinquenta anos para se desenvolver.[13]
Os fatores que aumentam o risco de desenvolver basalioma incluem[14][15][16][17][18]:
- Exposição prolongada, constante e cumulativa à radiação ultravioleta, principalmente durante a juventude (principal fator de risco para desenvolver um câncer de pele),[19]
- Radiação ionizante,
- Exposição a arsênio,
- Dieta altamente calórica,
- Deficiências na ingestão de vitaminas A, C, E, zinco e selênio;
- Pele clara, cabelos loiros ou ruivos e olhos claros,[20]
- Histórico familiar de câncer de pele,[21][22]
- Tratamento imunosupressivo,[23]
- Mais de 50 anos,
- Síndromes genéticas como Síndrome de Gorlin(síndrome de carcinoma basocelular nevoide) e Xeroderma pigmentosum (pele seca e pigmentada)[24]
Sinais e sintomas
[editar | editar código-fonte]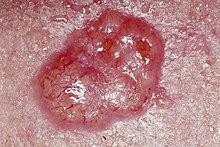
Carcinoma basocelular ocorre em diferentes locais do corpo, mas aproximadamente 80% ocorre na cabeça ou pescoço. É mais prevalente em adultos do sexo masculino. Geralmente têm o aspecto de pequenas feridas ou cicatrizes, onde podem eventualmente se formar vasos dilatados (telangiectasias). Uma forma comum é o aspecto de uma úlcera, com o centro mais definidamente ulcerado.
A lesão é descrita normalmente como uma pequena ferida que cresce de maneira lenta. Costuma não cicatrizar ou cicatrizar e novamente formar uma ferida ao menor trauma. Quando traumatizada, a lesão costuma sangrar.
Para a identificação da doença, devem ser levados em questão os seguintes pontos do histórico da pessoa: 1) exposição ao sol de maneira crônica, recreativa ou ocupacional; 2) exposição ocasional à radiação ionizante; 3) histórico de contato com arsênio.
O crescimento do tumor é lento, mas se for negligenciado pode se espalhar de forma profunda e causar grande destruição, principalmente entre os olhos, nariz ou orelha. Pode se estender até mesmo aos ossos.
Tipos
[editar | editar código-fonte]Fisicamente, o carcinoma basocelular pode ser dividido em[25]:
- Nodular: é o tipo mais comum e usualmente se apresenta como uma pápula colorida, com telangiectases. Quando ele enlarga, frequentemente seu centro ulcera, deixando um borda elevada.
- Cístico: é uma variação do nodular, sendo muito parecido com esse caso. Pode ter uma aparência polipóide. O centro do tumor é cístico.
- Pigmentado: é também uma variação do nodular, que tem máculas que variam entre o preto e o marrom em algumas ou todas as áreas, o que o torna difícil de diferenciar de um melanoma. Algumas áreas desses tumores não retém pigmentos; bordas elevadas com telangiectases, que são típicas, podem ser observadas. Isso ajuda a diferenciar de um melanoma.
- Morféico: caracateriza-se pelo fato de suas células induzirem a proliferação de fibroblastos na derme e uma deposição maior de colágeno. Clinicamente se parece com uma cicatriz que raramente sofre ulceração. Como o tumor se infiltra entre fibras de colágeno, o tratamento é difícil.
- Superficial: aparece como um eritema. Esse tipo é geralmente não elevado, bem demarcado com placas de eritema, o que pode dificultar o diagnóstico.
Diagnóstico
[editar | editar código-fonte]O diagnóstico é feito removendo uma amostra para analisar ao microscópio (biópsia). Histologicamente, o CB pode apresentar os seguintes padrões[25]:
- Nodular-ulcerativo: é o mais comum, consistindo de ilhas de tumores largas, redondas ou ovais, na derme e frequentemente ligados à epiderme.
- Micronodular: é similar ao nodular, mas com ilhas de tumor com agrupamentos muito pequenos de células. Esse é um tipo mais agressivo e com maior poder de espalhamento.
- Pigmentado: formado por ilhas de tumor largas, redondas ou ovais, com grandes agrupamentos de melanina
- Cístico: consiste de ilhas largas, redondas ou ovais, com secreções de glicoproteínas ao centro.
- Infiltrativo: é um tipo comum e agressivo, onde células basalóides se infiltram entre o colágeno
- Morféico: consiste de células basalóides alongadas, que formam tecido conjuntivo adjacente e denso
- Superficial: consiste de células basofílicas, na derme papilar ou na derme reticular superficial, mas estão aderidas à epiderme
Epidemiologia
[editar | editar código-fonte]No Brasil em 2010 houve 115 mil novos casos. Afeta 85 em cada 100 mil pessoas por ano na região Sul e 25 em cada 100 mil por ano na região Norte. Descendentes de alemães são mais vulneráveis com 95 em cada 100 mil e negros são menos vulneráveis. No mundo é 50% mais comum em homens, mas no Brasil o risco homem:mulher é quase o mesmo. O número de casos está aumentando em todo o mundo, especialmente EUA com quase um milhão de casos por ano e Austrália com 726 para cada 100 mil habitantes/ano (7 vezes mais risco que o Brasil).[26]
Tratamento
[editar | editar código-fonte]A modalidade de tratamento deve levar em conta diversos aspectos. Uma avaliação do tamanho da lesão é importante, pois lesões grandes têm um alto índice de recorrência. É importante considerar se o câncer é primário (previamente não tratado) ou recorrente. O índice de cura diminui muito para lesões recorrentes. Em 5 anos o índice de cura para modalidades de tratamento não-Mohs (radioterapia, crioterapia, curetagem e excisão cirúrgica) decai de 91,3% para tumores primários, para 80,1% para tumores recorrentes.[27][28] A histologia do tumor também deve ser considerada. Os padrões micronodular, infiltrativo e morféico são considerados agressivos e tem altas chances de recorrência;[29] para tumores morféicos a extensão além da margem clínica (não aparente na lesão) é de 7,2mm ± 3,8mm.[30] Assim, para prover uma margem livre em 98% dos tumores morféicos, é preciso uma margem de 2 cm, numa circunferência em torno da lesão aparente.
- Cirurgia micrográfica de Mohs
- é o tratamento com maiores índices de cura possíveis, sendo o tratamento de escolha para lesões de alto risco. A técnica envolve a remoção do tumor aparente, junto com uma margem de segurança em geral menor do que na excisão convencional. O tecido retirado é congelado num criostato, durante a cirurgia, e em seguida pode ser examinado no microscópio. Se houver alguma margem comprometida, é realizada uma nova excisão e o procedimento é repetido, até que se obtenham margens livres. O tecido é mapeado, de forma que excisões subsequentes são direcionadas ao foco persistente de tumor, o que evita o sacrifício de tecido normal. Com essa técnica, quase 100% das margens são examinadas. Numa revisão, Rowe et al concluíram que o índice de recorrência em 5 anos para CBs primários tratados com modalidades não-Mohs foi de 8,7%; enquanto que foi de apenas 1% quando se utilizou a técnica da cirúrgia micrográfica de Mohs. Já para os tumores recorrentes, os resultados foram de 19,9% e 5,6%, respectivamente.[27][28]
- Excisão cirúrgica com margens pré-determinadas
- tem por objetivo retirar todo o tumor, incluindo o tumor visível clinicamente e uma margem de pele aparentemente normal. O tecido retirado é enviado a um patologista para analisar se as margens estão livres. O método requer sacrifício de tecido normal para se obter taxas de cura aceitáveis. Margens de pelo menos 4 milímetros são recomendadas, mesmo para os CBs menos agressivos, para se obter um índice de cura de 95%.[31]
- Curetagem
- tem em vista retirar o tumor utilizando um curete (um instrumento em forma de colher). Pode ser utilizada em lesões de baixo risco (pequenas, com bordas definidas, primárias e com histologia não agressiva). Uma revisão da literatura, desde 1947, indica uma taxa de cura de 92,3% para CBs primários.[27] Entretanto, uma revisão semelhante indicou taxa de cura de apenas 60% para lesões recorrentes.[28]
- Radioterapia
- continua sendo um tratamento útil em geral para pacientes idosos, com lesões extensas, que não são candidatos a um procedimento cirúrgico.[32][33][34] Os resultados cosméticos iniciais tendem a ser bons; entretanto, resultados de longo prazo podem piorar. Uma desvantagem dessa técnica é que as margens cirúrgicas não podem ser analisadas, para avaliar se estão livres de tumor. Outra desvantagem é que tratar novamente tumores recorrentes com radioterapia nem sempre é possível nem indicado. Além disso, a radioterapia pode prejudicar o tratamento de tumores recorrentes. Existem indícios de que tumores recorrentes de lesões tratadas com radioterapia tendem a ser agressivos e infiltrativos.[35][36][37]
- Crioterapia
- é um tratamento utilizado para CBs não agressivos, com índices de cura em torno de 90%. Crioterapia pode resultar em feridas que demoram para sarar. Além disso, não há tecido disponível para exame histológico após o procedimento.
- Interferon alfa intralesional ou perilesional
- mostrou sucesso no tratamento de diversos CBs. Em geral é administrado 3 vezes por semana durante 3 semanas. Os índices de cura reportados variam, dependendo de diversos fatores como a agressividade do tumor. Em um estudo com 172 pacientes portadores de CBs superficiais e nodulo-ulcerados apresentou um índice de cura de 86%.[38] Um dos maiores estudos de longo prazo já publicado, com seguimento médio de 10,5 anos para 50 pacientes com tumores superficiais e nodulo-ulcerados reportou um índice de cura de 96%.[39] Uma grande vantagem é o fato de que os resultados cosméticos são excelentes, pois não há a cicatriz cirúrgica. Além disso, o tratamento pode ser utilizado para diminuir o tamanho da lesão antes do tratamento cirúrgico, o que facilita a excisão do tumor.[40][41][42][43][44] Alguns autores mostram o uso como tratamento coadjuvante em tumores com margens comprometidas.[40][45] Essa modalidade de tratamento é sub-utilizada ; isso se deve, entre outros motivos, ao fato de que o índice de cura pode não justificar economicamente o custo. Uma desvantagem é o fato de serem precisas muitas visitas ao centro médico e longo período de seguimento.
- Creme imiquimod 5%
- tem sido utilizado para o tratamento de CBs superficiais. Apesar de seu modo de ação não ser totalmente conhecido, acredita-se que imiquimod age modificando a resposta imunológica e estimulando apoptóse em células defeituosas. Em geral é aplicado 5 vezes por semana, durante 6 semanas. A taxa de cura para CBs superficiais varia entre 70 a 100%.
- Creme fluorouracil 5%
- é utilizado para tratar CBs superficiais e pequenos. O índice de cura é de aproximadamente 80%. Em geral é aplicado duas vezes ao dia, por 3 a 6 semanas.[46]
Ligações Externas
[editar | editar código-fonte]- (em inglês) Artigo com fotos em Skin Cancer Foundation
- (em inglês) Artigo com fotos em Medline Plus
- (em inglês) Artigo com fotos em DermNet
- Artigo sobre cirurgia micrográfica de Mohs na SBCD
- Artigo sobre cirurgia micrográfica de Mohs em Dermatologia.Net
Referências
- ↑ a b «Skin Cancer Treatment (PDQ®)». NCI. 25 de outubro de 2013. Consultado em 30 de junho de 2014. Cópia arquivada em 5 de julho de 2014
- ↑ a b c d e f g h i j Gandhi, SA; Kampp, J (novembro de 2015). «Skin Cancer Epidemiology, Detection, and Management.». The Medical clinics of North America. 99 (6): 1323–35. PMID 26476255
- ↑ a b «Skin Cancer Treatment». National Cancer Institute (em inglês). 21 de junho de 2017. Consultado em 2 de julho de 2017. Cópia arquivada em 4 de julho de 2017
- ↑ Krutmann, Jean; Humbert, Philippe (2010). Nutrition for Healthy Skin: Strategies for Clinical and Cosmetic Practice (em inglês). [S.l.]: Springer Science & Business Media. p. 31. ISBN 9783642122644. Cópia arquivada em 10 de setembro de 2017
- ↑ a b World Cancer Report 2014. [S.l.]: World Health Organization. 2014. pp. Chapter 5.14. ISBN 9283204298
- ↑ GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1459–1544. PMC 5388903
 . PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
- ↑ a b Cakir, BÖ; Adamson, P; Cingi, C (novembro de 2012). «Epidemiology and economic burden of nonmelanoma skin cancer.». Facial plastic surgery clinics of North America. 20 (4): 419–22. PMID 23084294. doi:10.1016/j.fsc.2012.07.004
- ↑ Gallagher, RP; Lee, TK; Bajdik, CD; Borugian, M (2010). «Ultraviolet radiation.». Chronic diseases in Canada. 29 Suppl 1: 51–68. PMID 21199599
- ↑ Jou, PC; Feldman, RJ; Tomecki, KJ (junho de 2012). «UV protection and sunscreens: what to tell patients.». Cleveland Clinic journal of medicine. 79 (6): 427–36. PMID 22660875. doi:10.3949/ccjm.79a.11110
- ↑ a b «Skin Cancer Treatment». National Cancer Institute (em inglês). 21 de junho de 2017. Consultado em 2 de julho de 2017. Cópia arquivada em 4 de julho de 2017
- ↑ Dubas, LE; Ingraffea, A (fevereiro de 2013). «Nonmelanoma skin cancer.». Facial plastic surgery clinics of North America. 21 (1): 43–53. PMID 23369588. doi:10.1016/j.fsc.2012.10.003
- ↑ Donovan J. Review of the hair follicle origin hypothesis for basal cell carcinoma. Dermatol Surg. 2009;35:1311-23.
- ↑ Roewert-Huber J, Lange-Asschenfeldt B, Stockfleth E, Kerl H. Epidemiology and aetiology of basal cell carcinoma. Br J Dermatol. 2007;157(Suppl 2):47-51.
- ↑ Yamada M, Kodama K, Fujita S, Akahoshi M, Yamada S, Hirose R, et al. Prevalence of skin neoplasms among the atomic bomb survivors. Radiat Res 1996;146: 223-6
- ↑ Maloney ME. Arsenic in dermatology. Dermatol Surg 1996;22: 301-4
- ↑ Zanetti R, Rosso S, Martinez C, Navarro C, Scraub S, Sancho-Garnier H, et al. The multicentre south European study "helios" I: skin characteristics and sunburns in basal cell and squamous cell carcinomas of the skin. Br J Cancer 1996;73: 1440-6
- ↑ Rosso S, Zanetti R, Martinez C, Tormo MJ, Scraub S, Sancho-Garnier H, et al. The multicentre south European study "helios" II: different sun exposure patterns in the aetiology of basal and squamous cell carcinomas of the skin. Br J Cancer 1996;73: 1447-54
- ↑ Corona R, Dogliotti E, D'Errico M, Sera F, Iavarone I, Baliva G, et al. Risk factors for basal cell carcinoma in a Mediterranean population. Arch Dermatol 2002;137: 1162-8
- ↑ Gallagher RP, Hill GB, Bajdik CD, Fincham S, Coldman AJ, McLean DI, et al. Sunlight exposure, pigmentary factors, and risk of nonmelanocytic skin cancer. Arch Dermatol 1995;131: 157-63
- ↑ Lear JT, Tan BB, Smith AP, Bowers W, Jones PW, Heagerty AH, et al. Risk factors for basal cell carcinoma in the UK: case-control study in 806 patients. J R Soc Med 1997;90: 371-4
- ↑ Ramachandran S, Fryer AA, Lovatt T, Lear JT, Smith AG, Strange RC. Susceptibility and modifier genes in cutaneous basal cell carcinomas and their associations with clinical phenotype. J Photochem Photobiol 2001;63: 1-7
- ↑ Ramachandran S, Fryer AA, Smith AG, Lear JT, Bowers B, Jones PW, et al. Cutaneous basal cell carcinomas: distinct host factors are associated with the development of tumors on the trunk and on the head and neck. Cancer 2001;92: 354-8
- ↑ Hartevelt MM, Bavinck JN, Kootte AM, Vermeer BJ, Vandenbroucke JP. Incidence of skin cancer after renal transplantation in the Netherlands. Transplantation 1990;49: 506-9
- ↑ http://www.mayoclinic.org/diseases-conditions/basal-cell-carcinoma/basics/risk-factors/con-20028996
- ↑ a b Wong CSM, Strange RC, Lear JT. Clinical review: basal cell carcinoma. BMJ; 327:794–798
- ↑ CHINEM, Valquiria Pessoa and MIOT, Hélio Amante. Epidemiologia do carcinoma basocelular. An. Bras. Dermatol. [online]. 2011, vol.86, n.2 [cited 2016-04-07], pp.292-305. Available from: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0365-05962011000200013&lng=en&nrm=iso>. ISSN 0365-0596. http://dx.doi.org/10.1590/S0365-05962011000200013.
- ↑ a b c Rowe DE, Carrol R, Day CL Jr. Long-term recurrence rates in previously untreated (primary) basal cell carcinoma: implications for patient follow-up. J Dermatol Surg Oncol 1989; 15:315-28
- ↑ a b c Rowe DE, Carrol R, Day CL Jr. Mohs surgery is the treatment of choice for recurrent (previously treated) basal cell carcinoma. J Dermatol Surg Oncol 1989; 15:424-31
- ↑ Sexton M, Jones DB, Maloney ME. Histologic pattern analysis of basal cell carcinoma: study of a series of 1039 consecutive neoplasms. J Am Acad Dermatol 1990;23:1118-26
- ↑ Salasche SJ, Amonette RA. Morheaform basal-cell ephiteliomas: a study of subclinical extensions in a series of 51 cases. J Dermatol Surg Oncol 1981 7:387-94
- ↑ Telfer NR, Colver GB, Bowers PW. Guidelines for the management of basal cell carcinoma. Br J Dermatol 1999;141: 415-23
- ↑ Liu FF, Maki R, Warde P, Payne D, Fitzpatrick P. A management approach to incompletely excised basal cell carcinomas of skin. Int J Radiat Oncol Biol Phys 1991; 20: 423-8
- ↑ Silverman MK, Kopf AW, Gladstein AH, Bart RS, Grin CM, Levenstein MJ. Recurrence rates of treated basal cell carcinomas. Part 4: X-ray therapy. J Dermatol Surg Oncol 1992; 18: 549-54
- ↑ Silverman MK, Kopf AW, Bart RS, Grin CM, Levenstein MJ. Recurrence rates of treated basal cell carcinomas. Part 3: Surgical excision. J Dermatol Surg Oncol 1992; 18: 471-6
- ↑ Richmond JD, Davie RM. The significance of incomplete excision in patients with basal cell carcinoma. Br J Plast Surg 1987; 40: 63-7
- ↑ Smith SP, Grande DJ. Basal cell carcinoma recurring after radiotherapy: a unique dificult treatment subclass of recurrent basal cell carcinoma. J Dermatol Surg Oncol 1991; 17: 26-30
- ↑ Smith SP, Foley EH, Grande DJ. Use of Mohs micrographic surgery to establish quantitative proof of heightened tumor spread in basal cell carcinoma recurrent following radiotherapy. J Dermatol Surg Oncol 1990; 16: 1012-16
- ↑ Cornell RC, Greenway HT, Tucker SB, Edwards L, Ashworth S, Vance JC, Tanner DJ, Taylor EL, Smiles KA, Peets EA. Intralesional interferon therapy for basal cell carcinoma. J Am Acad Dermatol. 1992 Jan;26(1):142-3
- ↑ Tucker SB, Polasek JW, Perri AJ, Goldsmith EA. Long-term follow-up of basal cell carcinomas treated with perilesional interferon alfa 2b as monotherapy. J Am Acad Dermatol. 2006 Jun;54(6):1033-8
- ↑ a b Fenton S, Kennedy S, Moriarty P. The role of interferon alpha 2b as an adjunctive treatment in the management of aggressive basal cell carcinoma of the eyelids. Acta Ophthalmol Scand. 2002 Dec;80(6):674-5
- ↑ Dogan B, Harmanyeri Y, Baloglu H, Ibrahim O. Intralesional alfa-2a interferon therapy for basal cell carcinoma. Cancer Letters 91 (1995) 215-219
- ↑ Stenquist B, Wennberg AM, Gisslén H, Larkö O. Treatment of aggressive basal cell carcinoma with intralesional interferon: evaluation of efficacy by Mohs surgery. J Am Acad Dermatol. 1992 Jul;27(1):65-9
- ↑ Chimenti S, Peris K, Di Cristofaro S, Fargnoli MC, Torlone G. Use of recombinant interferon alfa-2b in the treatment of basal cell carcinoma. Dermatology. 1995;190(3):214-7
- ↑ Bostanci S, Kocyigit P, Alp A, Erdem C, Gurgey E. Treatment of basal cell carcinoma located in the head and neck region with intralesional interferon alpha-2a - Evaluation of long-term follow-up results. Clinical Drug Investigation 25 (10): 661-667 2005
- ↑ Kim KH, Yavel RM, Gross VL, Brody N. Intralesional Interferon a-2b in the Treatment of Basal Cell Carcinoma and Squamous Cell Carcinoma: Revisited. Dermatologic Surgery 30 (1), 116–120
- ↑ Goette DK. Topical chemotherapy with 5-fluorouracil. J Am Acad Dermatol 1981;6: 633-49

