Câncer de próstata
| Câncer de próstata/Cancro da próstata | |
|---|---|
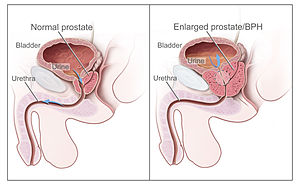 Caso não tratado, o câncer de próstata invade órgãos próximos como bexiga, vesículas seminais, reto e se espalha pelo organismo danificando outros órgãos. | |
| Especialidade | oncologia, urologia |
| Classificação e recursos externos | |
| CID-10 | C61 |
| CID-9 | 185 |
| CID-11 | 1552457716 |
| OMIM | 176807 |
| DiseasesDB | 10780 |
| MedlinePlus | 000380 |
| eMedicine | radio/574 |
Câncer de próstata (português brasileiro) ou cancro da próstata (português europeu), também denominado de carcinoma da próstata, é uma neoplasia que tem seu desenvolvimento na próstata, uma glândula do sistema reprodutor masculino. A maioria dos cânceres de próstata é de crescimento lento, no entanto, alguns crescem relativamente rápido. As células cancerosas podem espalhar-se a partir da próstata para outras partes do corpo, particularmente os ossos e os linfonodos. Inicialmente pode ser assintomática, mas em estágios avançados pode causar dificuldade para urinar, presença de sangue na urina ou dor na pelve, costas ou ao urinar. Os sinais clínicos são muito semelhantes aos da hiperplasia benigna da próstata. Outros sintomas tardios podem incluir sensação de cansaço devido aos baixos níveis de células vermelhas no sangue e disfunção erétil.
As taxas de incidência deste tipo de carcinoma variam amplamente no mundo: o câncer é menos comum no sul e leste da Ásia e mais comum na Europa e Estados Unidos.[1] O câncer é menos comum entre homens asiáticos e mais comum entre homens negros.[2][3]
Este tipo de câncer se desenvolve mais frequentemente em homens acima dos 50 anos de idade. Ocorre somente em homens, já que a próstata é uma glândula exclusiva deste sexo. É o tipo de câncer mais comum em homens nos Estados Unidos, país em que é a segunda maior causa de mortes masculinas por câncer, atrás somente do câncer de pulmão. Entretanto, muitos homens que desenvolvem câncer de próstata não apresentam sintomas e acabam morrendo por outras causas. Muitos fatores, incluindo genética e dieta, têm sido relacionados ao desenvolvimento do câncer de próstata.
O câncer de próstata é mais frequentemente descoberto através de exame físico ou por monitoração dos exames de sangue, como o teste do "PSA" (sigla em inglês para antígeno prostático específico). Atualmente existe alguma preocupação sobre a acurácia do teste de PSA e sua real utilidade. Uma suspeita de câncer de próstata é tipicamente confirmada ao se remover uma amostra da próstata (biópsia) e examinando-a sob microscópio. Outros exames, como raio-X e exames de imagem para os ossos, podem ser realizados para determinar se o câncer de próstata se espalhou.
O câncer de próstata pode ser tratado com cirurgia, radioterapia, terapia hormonal, quimioterapia, proteinoterapia ou alguma combinação destes. A idade e saúde do homem, assim como a extensão da dispersão das células, aparência sob análise microscópica e resposta do câncer ao tratamento inicial são importantes em determinar o desfecho da doença. Já que o câncer de próstata é uma doença de homens idosos, muitos irão morrer de outras causas antes que uma lenta evolução do câncer de próstata possa se espalhar ou causar sintomas. Isso faz com que a escolha do tratamento a ser utilizado seja difícil.[4] A decisão de tratar ou não um câncer de próstata localizado (um tumor que está contido no interior da próstata) com intenção de cura é um dilema entre os benefícios esperados e os possíveis efeitos danosos em relação à sobrevivência e qualidade de vida do paciente.
Sinais e sintomas
[editar | editar código-fonte]O câncer de próstata precoce não causa sintomas. Geralmente é diagnosticado após um teste de PSA elevado. Às vezes, entretanto, o câncer de próstata causa sintomas semelhantes aos da hiperplasia prostática benigna. Estes sintomas incluem polaciúria, urinar mais à noite, dificuldade em iniciar e manter um jato contínuo de urina, sangue na urina e ato de urinar doloroso. O câncer de próstata pode também causar problemas com a função sexual, como dificuldade em atingir uma ereção ou ejaculação dolorosa.[5]
O câncer de próstata avançado pode causar sintomas adicionais à medida que a doença se espalha para outras partes do corpo. O sintoma mais comum é dor óssea, geralmente nas vértebras (ossos da coluna), pelve ou costelas, do câncer que se espalhou para estes ossos. O câncer de próstata na coluna pode também comprimir a medula espinhal, causando fraqueza nas pernas e incontinência urinária e fecal.[6]
Patofisiologia
[editar | editar código-fonte]
A próstata é um órgão do sistema reprodutor masculino que ajuda a produzir e armazenar o fluido seminal. Em homens adultos, a próstata normal mede cerca de 3 centímetros de comprimento e pesa em torno de vinte gramas.[7] Ela está localizada na pelve, abaixo da bexiga urinária e na frente do reto. A próstata envolve parte da uretra, o duto que carrega a urina da bexiga durante a micção e carrega o sêmen durante a ejaculação.[8] Devido a sua localização, as doenças da próstata geralmente afetam o controle urinário, a ejaculação e raramente a defecação. A próstata contém pequenas glândulas que produzem cerca de vinte por cento do fluido que constitui o sêmen.[9] No câncer de próstata, estas células sofrem mutações e se transformam em células cancerosas. As glândulas da próstata necessitam de hormônios masculinos, conhecidos como andrógenos, para funcionar corretamente. Os andrógenos incluem a testosterona, que é produzida nos testículos, a desidroepiandrosterona, produzida nas supra-renais e a Di-hidrotestosterona, que é convertida a partir da testosterona no interior da próstata. Os andrógenos também são responsáveis pelas características sexuais secundárias dos homens, como os pêlos da face e aumento da massa muscular.
O câncer de próstata é classificado como um adenocarcinoma, ou câncer glandular, que inicia quando as células glandulares secretoras da próstata sofrem mutações e se transformam em células cancerosas. A região da próstata em que o adenocarcinoma é mais comum é a zona periférica. Inicialmente, pequenos agrupamentos de células cancerosas se mantêm confinados às glândulas prostáticas normais, uma condição conhecida como carcinoma in situ ou neoplasia intraepitelial prostática (NIP ou PIN). Embora não haja prova de que a NIP seja uma precursora do câncer, ela está intimamente relacionada ao câncer. Ao longo do tempo estas células cancerosas começam a se multiplicar e se espalhar para o tecido prostático circundante (o estroma) formando um tumor. Eventualmente, o tumor pode crescer ao ponto de invadir órgãos próximos a ele, como as vesículas seminais ou o reto. As células tumorais ainda podem desenvolver a habilidade de viajar através da corrente sanguínea e sistema linfático. O câncer de próstata é considerado um tumor maligno porque é uma massa de células que pode invadir outras partes do corpo. Esta invasão de outros órgãos é chamada de metástase. O câncer de próstata geralmente gera metástase nos ossos e linfonodos, e pode invadir o reto, bexiga e ureteres após a progressão local. A via de metástase para os ossos é possivelmente a venosa, uma vez que o plexo venoso prostático que faz drenagem da próstata conecta-se com as veias vertebrais.[10]
Diagnóstico
[editar | editar código-fonte]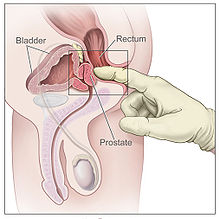
Biópsia
[editar | editar código-fonte]Se há suspeita de câncer, realiza-se uma biópsia da próstata. Durante a biópsia o urologista obtém amostras do tecido da próstata através do reto. Uma pistola de biópsia insere e remove agulhas especiais (geralmente três a seis em cada lado da próstata) em menos de um segundo. As biópsias de próstata são feitas rotineiramente e raramente necessitam de hospitalização. Cinquenta e cinco por cento dos homens relatam desconforto durante o procedimento.[12]
Escore de Gleason
[editar | editar código-fonte]As amostras de tecido da próstata são então examinadas sob microscópio para determinar se há presença de células cancerosas e para avaliar as características microscópicas (ou escore de Gleason) de algum câncer encontrado.
Marcadores tumorais
[editar | editar código-fonte]As amostras de tecidos podem ser coradas para investigação da presença de antígeno prostático específico (PSA) ou outros marcadores tumorais a fim de determinar a origem de células malignas que sofreram metástase.[13]
Estadiamento
[editar | editar código-fonte]Uma importante parte na avaliação do câncer de próstata é a determinação do estágio, que significa o quão longe o câncer já se espalhou. Conhecer o estágio ajuda a definir o prognóstico e é útil para se escolher a terapia. O sistema mais comum é o sistema de quatro estágios, o sistema TNM (abreviação para Tumor/linfoNodos/Metástases). Seus componentes incluem o tamanho do tumor, o número de linfonodos envolvidos e a presença de alguma metástase.
A distinção mais importante feita pelo estadiamento é se o câncer está ou não ainda confinado à próstata. No sistema TNM, os cânceres T1 e T2 são encontrados somente na próstata, ao passo que os T3 e T4 já se espalharam. Diversos testes podem ser usados para procurar evidências da dispersão do câncer (metástase). Eles incluem tomografia computadorizada para avaliar a dispersão na pelve, cintilografia dos ossos para procurar sinais nos ossos e ressonância magnética para avaliar a cápsula prostática e vesículas seminais. Os exames dos ossos mostram aparência osteoblástica devido a uma densidade óssea aumentada nas áreas em que há metástase óssea - em oposição ao que é observado em muitos outros cânceres que metastatizam.
Depois de uma biópsia da próstata, o patologista observa as amostras sob microscópio. Se o câncer estiver presente, o patologista relata o grau do tumor. O grau revela quanto o tumor se diferencia do tecido prostático normal e sugere quão rápido o tumor irá crescer. O sistema de Gleason é usado para graduar tumores de 2 a 10, sendo o escore de Gleason 10 indicando as maiores anomalias. O patologista atribui um número de 1 a 5 para o padrão mais comum observado na amostra sob o microscópio, e então atribui outro número de 1 a 5 para o segundo padrão mais comum. A soma destes dois números é o escore de Gleason. A graduação adequada do tumor é crítica, já que o grau do tumor é um dos principais fatores usados para determinar qual tratamento será recomendado.
Rastreamento ou detecção precoce
[editar | editar código-fonte]O exame de rastreamento, detecção precoce, geralmente é realizado pelo exame do PSA e pelo exame digital da próstata (o toque retal). Recentemente, novas recomendações têm sido feitas pelas grandes sociedades especializadas. Um estudo europeu demonstrou que os homens com idade de 55 a 69 anos são os que mais se beneficiam quando submetidos aos exames periódicos. (Shröeder, F. NEJM 2008) Entretanto, existe o risco do diagnóstico de tumores ditos insignificantes, pouco agressivos, que podem nunca progredir. Além do tratamento que pode trazer complicações. Provavelmente, a conduta mais correta é ter as dúvidas esclarecidas, sobre riscos e benefícios com o urologista.
Tratamento
[editar | editar código-fonte]O tratamento é variável e depende do estadiamento da neoplasia que, a grosso modo, pode ser dividido em tumor localizado e tumor metastático. O tratamento do tumor localizado pode ser cirúrgico ou radioterápico. O tratamento de tumor metastático baseia-se no bloqueio hormonal da testosterona, inibindo assim o crescimento da massa tumoral sendo frequentemente um tratamento adicional importante. Podem ser utilizados vários tipos de drogas com eficácia e efeitos colaterais variáveis que devem ser levados em conta no momento da escolha do tratamento.
Cirurgia
[editar | editar código-fonte]A remoção cirúrgica da próstata, ou prostatectomia, é um tratamento comum tanto para os cânceres de estágio precoce, quanto para cânceres que falharam em responder à radioterapia. O tipo mais comum é a prostatectomia retropúbica radical, quando o cirurgião remove a próstata através de uma incisão abdominal. Outro tipo é a prostatectomia perineal radical, quando o cirurgião remove a próstata através de uma incisão no períneo, a pele entre o escroto e o ânus. A prostatectomia radical pode também ser realizada laparoscopicamente, através de diversas pequenas incisões (1 cm) no abdômen, com ou sem o auxílio de um robô cirúrgico. A cirurgia robótica é o método preferido no caso de pacientes obesos, devido à dificuldade das operações por cirurgia aberta e por laparoscopia.[14] Porém esse procedimento demora mais tempo, em média o dobro em relação à cirurgia aberta.[14]
A prostatectomia radical é eficiente contra tumores que ainda não se espalharam além da próstata;[15] com as taxas de cura dependendo dos fatores de risco como o nível de PSA e escore de Gleason. Entretanto, ela pode causar lesão nos nervos que significativamente pode alterar a qualidade de vida de um sobrevivente do câncer de próstata. As complicações sérias mais comuns da cirurgia são incontinência urinária e impotência. Embora a sensação peniana e a habilidade de se atingir o orgasmo geralmente permaneçam intactas, a ereção e ejaculação frequentemente são prejudicadas. Medicamentos como a sildenafila (Viagra), tadalafila (Cialis) ou vardenafila (Levitra) podem recuperar em algum grau a potência. Para a maioria dos homens com doença restrita à próstata, uma técnica cirúrgica que preserva os nervos pode ajudar a evitar a incontinência urinária e impotência.[16]
A prostatectomia radical tem tradicionalmente sido utilizada sozinha quando o câncer é pequeno. Quando há margens positivas ou doença localmente avançada, a radioterapia adjuvante pode oferecer uma melhor sobrevivência. A cirurgia também pode ser oferecida quando o câncer não responde à radioterapia. Entretanto, como a radioterapia causa mudanças teciduais, a prostatectomia após a radioterapia possui um risco maior de complicações.
Prostatectomia radical laparoscópica e laparoscópica assistida por robô
[editar | editar código-fonte]Apesar de descrita no início dos anos 1990, somente após as modificações da técnica publicadas pelos urologistas do Institut Mutualiste Montsouris, em Paris, a cirurgia laparoscópica foi disseminada pelo mundo, permitindo bons resultados, similares a cirurgia aberta. A prostatectomia radical laparoscópica é forma mais moderna da clássica prostatectomia retropúbica radical. Em contraste com a cirurgia aberta do câncer de próstata, a prostatectomia radical não requer uma grande incisão. Utilizando tecnologia moderna, como a miniaturização e fibras ópticas, a prostatectomia radical laparoscópica é um tratamento minimamente invasivo para o câncer de próstata.
A prostatectomia radical assistida por robô, também chamada prostatectomia robótica, foi inicialmente realizada em Creteil-França e tornou-se a técnica mais realizada, atualmente, nas regiões onde é disponível. Existiam 2 sistemas robóticos utilizados nas cirurgias assistidas com robô: o primeiro e cuja produção foi interrompida, chamado ZEUS (que consistia em um console e 3 braços robóticos chamados AESOP) e o segundo sistema que, atualmente, é o único em uso, chamado Da Vinci que pode ter 3 e 4 braços. Nos dias atuais, apesar da rápida substituição da técnica com corte (cirurgia aberta) pela robótica, em países como nos EUA, os estudos médicos, não encontraram vantagens evidentes de uma técnica sobre a outra. O que parece ser mais importante é o especialista cirurgião urologista do que a via de acesso escolhida (aberta, laparoscópica ou assistida por robô), pois apresentam resultados semelhantes.
A ressecção transuretral de próstata, geralmente chamada de "RTU de próstata", é um procedimento cirúrgico realizado quando o canal entre a bexiga e o pênis (uretra) é bloqueado pelo aumento da próstata. A RTU de próstata é geralmente realizada para doença benigna (hiperplasia prostática benigna) e não é considerada um tratamento definitivo para o câncer de próstata. Durante o procedimento, um cistoscópio é inserido no pênis, e a próstata bloqueada é cortada.
Na doença metastática, quando o câncer já se espalhou além da próstata, a remoção dos testículos (chamada de orquiectomia) pode ser realizada para diminuir os níveis de testosterona e controlar o crescimento do câncer (Ver terapia hormonal, abaixo).
Radioterapia e suas modalidades
[editar | editar código-fonte]Trata-se de um tratamento curativo para doença localizada ou localmente avançada. Poucos estudos com poder de detectar diferenças significativas (chamados estudos clínicos randomizados) compararam a radioterapia com a cirurgia, na tentativa de avaliar se existe um tratamento melhor que o outro. Apenas um estudo clínico randomizado comparou a prostatectomia radical e a radioterapia e demonstrou que a cirurgia previne mais a disseminação do tumor, reduzindo a possibilidade de metástases. (Paulson, Lin et al. 1982). A radioterapia pode ser indicada para alívio sintomático de dores ósseas ocasionadas por metástases.
Observação (watchful waiting) e Seguimento ativo (active surveillance)
[editar | editar código-fonte]A simples observação (do inglês watchful waiting), isto é, apenas acompanhar os pacientes diagnosticados com câncer de próstata até que o paciente apresente sintomas e tratá-los de forma paliativa, isto é, não curativa, demonstrou ser uma modalidade de tratamento com piores resultados quando comparado à cirurgia radical. Pacientes operados apresentaram maior sobrevida geral, melhor sobrevida relacionada ao câncer e menor chance de metástases ao longo da vida.
O seguimento ativo (do inglês active surveillance) é uma modalidade onde o paciente é conduzido atentamente, com exames periódicos, existindo a necessidade de submeter o paciente a novas biópsias, optando por não tratar de imediato pacientes portadores de tumores de baixo risco de progressão. Desta forma, indicando o tratamento (seja prostatectomia radical seja radioterapia) somente aos pacientes em que o câncer progredir. Esta modalidade de tratamento tem a intenção de restringir a exposição aos riscos e complicações conhecidas (como incontinência urinária e disfunção sexual) a apenas os pacientes portadores de câncer não agressivos. Atualmente, devido a falta de acurácia em predizer quais pacientes são portadores de tumores de baixo-risco, o seguimento ativo é indicado a apenas um grupo restrito de pacientes portadores de tumores pouco agressivos ou com expectativa de vida < 10-15 anos, seja pela idade avançada, seja pelas doenças que o paciente já apresenta, as chamadas comorbidades (fumo, pressão alta, obesidade, sedentarismo...) que, por vezes, podem levar o paciente a morte antes do tumor progredir.
Terapia hormonal
[editar | editar código-fonte]A terapia hormonal usa medicamentos ou cirurgia para impedir que as células do câncer de próstata adquiram dihidrotestosterona (DHT), um hormônio produzido na próstata que é necessário para o crescimento e dispersão da maioria das células do câncer de próstata. O bloqueio do DHT geralmente faz com que o câncer de próstata pare de crescer e até mesmo diminua. Entretanto, a terapia hormonal raramente cura o câncer de próstata porque os cânceres que inicialmente respondem à terapia hormonal geralmente se tornam resistentes após um ou dois anos. A terapia hormonal é então usada quando o câncer já se espalhou da próstata. Também pode ser administrada para alguns homens que estão sob radioterapia ou fizeram cirurgia, para prevenir o retorno de seu câncer.[17]
A terapia hormonal para o câncer de próstata age nas vias metabólicas que o corpo usa para produzir a DHT. Um ciclo de retroalimentação envolvendo os testículos, hipotálamo, hipófise, supra-renais e próstata controla os níveis sanguíneos de DHT. Primeiro, os baixos níveis sanguíneos de DHT estimulam o hipotálamo a produzir hormônio liberador de gonadotrofina (GnRH). O GnRH então estimula a hipófise a produzir hormônio luteinizante (LH), o qual estimula os testículos a produzir testosterona. Finalmente, a testosterona dos testículos e a desidroepiandrosterona das glândulas supra-renais estimulam a próstata a produzir mais DHT. A terapia hormonal diminui os níveis de DHT pois interrompe esta via metabólica em algum ponto.
Existem diversas formas de terapia hormonal para o câncer de próstata:
- Orquiectomia é a cirurgia para remover os testículos. Como os testículos produzem a maior parte da testosterona do corpo, a sua remoção cirúrgica faz com que os níveis de testosterona caiam logo em seguida. Com isso, a próstata não somente deixa de receber estímulo da testosterona para produzir mais DHT, como também não possui testosterona suficiente para transformá-la em DHT.
- Antiandrógenos são medicamentos como flutamida, bicalutamida, nilutamida, e acetato de ciproterona que diretamente bloqueiam as ações da testosterona e da DHT no interior das células do câncer de próstata.
- Medicamentos que bloqueiam a produção dos andrógenos suprarrenais como a DHEA incluem o cetoconazol e a aminoglutetimida. Como as glândulas supra-renais produzem somente cerca de 5% dos andrógenos do corpo, estes medicamentos são geralmente usados somente em combinação com outros métodos que possam bloquear os 95% de andrógenos produzidos pelos testículos. Estes métodos combinados são chamados de bloqueio androgênico total (BAT). O BAT também pode ser obtido com o uso de antiandrógenos.
- A ação do hormônio liberador de gonadotrofina pode ser interrompida de duas maneiras. Os antagonistas do GnRH impedem a produção de LH diretamente, enquanto os agonistas do GnRH inibem o LH através de um processo de regulação para baixo (downregulation) após um efeito de estimulação inicial. Abarelix é um exemplo de antagonista do GnRH, enquanto os agonistas do GnRH incluem leuprolida, goserelin, triptorelin e buserelin. Inicialmente, os agonistas do GnRH aumentam a produção do LH. Entretanto, como o constante fornecimento desta medicação não coincide com o ritmo de produção natural do corpo, a produção de LH e GnRH diminui após algumas semanas.[18]
Os tratamentos hormonais que mais têm sucesso são a orquiectomia e os agonistas do GnRH. Apesar de seu elevado custo, os agonistas do GnRH são geralmente escolhidos ao invés da orquiectomia, por questões cosméticas e emocionais.
Cada tratamento possui desvantagens que limitam seu uso em certas circunstâncias. Apesar de a orquiectomia ser uma cirurgia de baixo risco, o impacto psicológico da remoção dos testículos pode ser significante. A perda de testosterona também causa ondas de calor, ganho de peso, perda da libido, aumento das mama (ginecomastia), impotência e osteoporose. Os agonistas do GnRH podem causar os mesmos efeitos da orquiectomia mas podem causar piores sintomas no início do tratamento. Quando os agonistas do GnRH começam a ser usados, os aumentos de testosterona podem levar a uma dor aumentada nos ossos (originada do câncer metastático), então antiandrógenos são usados para diminuir estes efeitos colaterais. Os estrógenos não são comumente utilizados pois eles aumentam o risco de doença cardiovascular e trombose. Os antiandrógenos geralmente não causam impotência e geram menos dor nos óssos e massa muscular. O cetoconazol pode causar lesões no fígado com o uso prologando e a aminoglutetimida pode causar rashes cutâneos.
Rastreamento
[editar | editar código-fonte]O rastreamento para o câncer de próstata é uma tentativa de encontrar tumores insuspeitos, podendo seguir-se de alguns testes mais invasivos, como a biópsia, com a retirada de amostras de células para um estudo mais aprofundado. As opções para o rastreamento incluem o exame digital da próstata, conhecido como "exame do toque retal", e a dosagem do antígeno prostático específico (PSA) no exame de sangue. O rastreio ainda é controverso e, em algumas pessoas, pode levar a procedimentos desnecessários e possivelmente danosos.[19] Os testes de rotina, toque retal e PSA, não apresentaram redução na mortalidade.[20]
O United States Preventive Services Task Force (USPSTF) não recomenda o teste de PSA para o rastreio do câncer de próstata em homens saudáveis, independente da idade.[21] Eles concluem que os benefícios potenciais do teste não superam os danos esperados.[22][23] O Centro de Controle e Prevenção de Doenças do governo americano compartilha da mesma conclusão.[24] A American Society of Clinical Oncology (Sociedade Americana de Oncologia Clínica) e o American College of Physicians (Colégio Americano de Médicos) recomendam que o rastreamento seja desencorajado naquelas pessoas cuja expectativa de vida é inferior a mais 10 a 15 anos, enquanto naqueles com maior expectativa de vida a decisão deve ser tomada pela pessoa em questão, baseada nos riscos e benefícios potenciais.[25] Em geral, baseado nas pesquisas recentes, conclui-se que "não está certo de que os benefícios associados à dosagem do PSA para o rastreio do câncer de próstata equivalem aos danos associados ao rastreio e ao tratamento subsequente desnecessário."[26] O guia AUA 2013 da American Urological Association (Associação Americana de Urologia) pondera sobre os benefícios de se prevenir a mortalidade por câncer de próstata em um a cada mil homens rastreados por um período de dez anos contra os danos reconhecidos associados aos testes diagnósticos e ao tratamento. O AUA recomenda a decisão compartilhada quanto ao rastreamento nos indivíduos entre 55 e 69 anos, e naqueles em que o rastreio for realizado, este não deve ocorrer com frequência maior do que uma vez a cada dois anos.[27]
Prognóstico
[editar | editar código-fonte]As taxas de câncer de próstata são maiores e o prognóstico é pior em países desenvolvidos do que no resto do mundo. Muito dos fatores de risco para o câncer de próstata são mais prevalentes nos países desenvolvidos, incluindo maior expectativa de vida e dietas rica em carne vermelha e derivados do leite.[28]
Também, onde há maior acesso a programas de monitoramento, existe uma taxa maior de detecção. O câncer de próstata é o nono câncer mais comum no mundo, mas é o primeiro câncer (excluindo os de pele) em homens nos Estados Unidos. O câncer de próstata afetou dezoito porcento dos homens norte-americanos e causou morte em 3% em 2005.[29] No Japão, as mortes por câncer de próstata foram 20% a 50% das taxas nos Estados Unidos e Europa nos anos 1990s.[30] Na Índia, nos anos 1990s, metade das pessoas com câncer de próstata restrito à próstata morreram em 10 anos.[31] Homens negros possuem 50-60 vezes mais câncer de próstata e mais mortes por câncer do que homens em Shanghai, China.[32] Na Nigéria, dois por cento dos homens desenvolvem câncer de próstata e 64% deles morrem após dois anos.[33]
Em pacientes sob tratamento, os indicadores de prognóstico clínico da doença são o estadiamento, o nível de PSA antes da terapia e a escala de Gleason. Em geral, quando maior o grau e o estadiamento, pior o prognóstico. Pode-se utilizar normogramas para calcular o risco estimado de um paciente. As predições são baseadas em experiências em grandes grupos de pacientes que sofreram de câncer em diversos estadiamentos.[34]
Em 1941, Charles Huggins relatou que a terapia de ablação androgênica causa a regressão do câncer primário e metastático andrógeno-dependente da próstata.[35] A terapia de ablação androgênica provoca remissão em 80-90% dos pacientes submetidos ao tratamento, resultando em uma sobrevida mediana de 12 a 33 meses. Após a remissão, um fenótipo andrógeno-independente tipicamente surge, por essa razão a sobrevida global média é 23-37 meses a partir da data do início da terapia de ablação androgênica.[36] Não está claro como o câncer de próstata se torna andrógeno-independente ou como ele restabelece a progressão, embora algumas possibilidades (sobre a forma) têm sido propostas. E a maneira como o câncer se modifica, para superar a falta de andrógeno, pode variar individualmente entre pacientes.[37]
Histórico
[editar | editar código-fonte]Apesar da próstata ter sido descrita pelo anatomista veneziano Niccolò Massa em 1536, e ilustrada pelo anatomista flamengo Andreas Vesalius em 1538, o câncer de próstata não foi identificado até 1853.[38] O câncer de próstata foi inicialmente considerada uma doença rara, provavelmente por causa da baixa expectativa de vida e métodos de detecção rudimentares do século XIX. Os primeiros tratamentos para o câncer foram cirurgias para aliviar a obstrução urinária.[39] A remoção de toda a glândula (prostatectomia radical perineal) foi realizada pela primeira vez em 1904 por Hugh H. Young no Johns Hopkins Hospital.[40] A remoção cirúrgica dos testículos (orquiectomia) para tratar o câncer de próstata foi realizada pela primeira vez na década de 1890, mas com sucesso limitado. A ressecção transuretral da próstata (RTU) substituiu a prostatectomia radical para o alívio sintomático da obstrução no meio do século XX, pois oferecia melhor preservação da função erétil peniana. Prostatectomia radical retropúbica foi desenvolvida em 1983 por Patrick Walsh. Esta abordagem cirúrgica permitiu a remoção dos gânglios linfáticos e da próstata, com a manutenção da função peniana.[41]
Em 1941, Charles B. Huggins publicou estudos em que utilizou estrogênio para se opor a produção de testosterona em homens com câncer de próstata metastático. Esta descoberta da "castração química" levou Huggins a ganhar o Prêmio Nobel de 1966 em Fisiologia ou Medicina.[42] O papel do hormônio liberador de gonadotrofinas (GnRH) na reprodução foi determinada por Andrzej W. Schally e Roger Guillemin, que ganharam em 1977 o Prêmio Nobel de Fisiologia ou Medicina por este trabalho. Agonistas dos receptores de GnRH, como leuprolide e goserelina, foram posteriormente desenvolvidas e utilizadas para tratar o câncer de próstata.[43][44]
A terapia de radiação para o câncer de próstata foi desenvolvida pela primeira vez no início do século XX e, inicialmente, consistia em implantes intraprostáticos de rádio. A radioterapia externa tornou-se mais popular como o aparecimento de aparelhos de raio-X mais fortes tornaram-se disponíveis em meados do século XX. A braquiterapia com bastões radioativos implantados (para o câncer de próstata) foi descrita pela primeira vez em 1983.[45]
Um estudo de 2019 usou a genética como uma medida da atividade física para analisar seu efeito no câncer de próstata e revela que ser mais ativo físico reduz o risco de câncer de próstata.[46]
Referências
- ↑ «IARC Worldwide Cancer Incidence Statistics—Prostate». JNCI Cancer Spectrum. Oxford University Press. 19 de dezembro de 2001 Retrieved on 2007-04-05 through the Internet Archive
- ↑ Overview: Prostate Cancer—What Causes Prostate Cancer? American Cancer Society (2006-05-02). Retrieved on 2007-04-05
- ↑ Prostate Cancer FAQs. Arquivado em 29 de maio de 2006, no Wayback Machine. State University of New York School of Medicine Department of Urology (2006-08-31). Retrieved on 2007-04-05
- ↑ «Detailed Guide: prostate cancer». American Cancer Society webpage
- ↑ Miller, DC; Hafez, KS, Stewart, A,; et al. (2003). «Prostate carcinoma presentation, diagnosis, and staging: an update form the National Cancer Data Base». Cancer. 98. 1169 páginas. PMID 12973840
- ↑ van der Cruijsen-Koeter, IW; Vis AN, Roobol MJ, Wildhagen MF, de Koning HJ, van der Kwast TH, Schroder FH (julho de 2005). «Comparison of screen detected and clinically diagnosed prostate cancer in the European randomized study of screening for prostate cancer, section rotterdam». Urol. 174 (1): 121-5. PMID 15947595
- ↑ Aumüller, G. (1979). Prostate Gland and Seminal Vesicles. Berlin-Heidecool.lberg: Springer-Verlag
- ↑ Moore, K.; Dalley, A. (1999). Clinically Oriented Anatomy. Baltimore, Maryland: Lippincott Williams & Wilkins
- ↑ Steive, H. (1930). «Männliche Genitalorgane». Handbuch der mikroskopischen Anatomie des Menschen. Vol. VII Part 2. Berlin: Springer. pp. 1–399
- ↑ «Male Genitals - Prostate Neoplasms». Pathology study images. University of Virginia School of Medicine. Consultado em 28 de abril de 2011
- ↑ http://www.uspreventiveservicestaskforce.org/prostatecancerscreening.htm
- ↑ Essink-Bot, ML; de Koning HJ, Nijs HG, Kirkels WJ, van der Maas PJ, Schroder FH (17 de junho de 1998). «Short-term effects of population-based screening for prostate cancer on health-related quality of life». J Natl Cancer Inst. 90 (12): 925-31. PMID 9637143
- ↑ Chuang AY, Demarzo AM, Veltri RW, Sharma RB, Bieberich CJ, Epstein JI (2007). «Immunohistochemical Differentiation of High-grade Prostate Carcinoma From Urothelial Carcinoma». 31 (8): 1246-1255. PMID 17667550. doi:10.1097/PAS.0b013e31802f5d33
- ↑ a b «LEMES, Conceição. "Tempos Modernos? Cirurgia robótica", in: Revista Onco&, Iaso Editora, Dezembro 2011/Janeiro-Fevereiro 2012» (PDF). Consultado em 2 de janeiro de 2012. Arquivado do original (PDF) em 29 de setembro de 2015
- ↑ Bill-Axelson A, Holmberg L, Ruutu M,; et al. (2005). «Radical prostatectomy versus watchful waiting in early prostate cancer». N. Engl. J. Med. 352 (19): 1977-84. PMID 15888698. doi:10.1056/NEJMoa043739
- ↑ Gerber, GS; Thisted RA, Scardino PT, Frohmuller HG, Schroeder FH, Paulson DF, Middleton AW Jr, Rukstalis DB, Smith JA Jr, Schellhammer PF, Ohori M, Chodak GW (28 de agosto de 1996). «Results of radical prostatectomy in men with clinically localized prostate cancer». JAMA. 276 (8): 615-9. PMID 8773633
- ↑ Robson, M; Dawson N (junho de 1996). «How is androgen-dependent metastatic prostate cancer best treated?». Hematol Oncol Clin North Am. 10 (3): 727-47. PMID 8773508 Review.
- ↑ Loblaw, DA; Mendelson DS, Talcott JA, Virgo KS, Somerfield MR, Ben-Josef E, Middleton R, Porterfield H, Sharp SA, Smith TJ, Taplin ME, Vogelzang NJ, Wade JL Jr, Bennett CL, Scher HI; American Society of Clinical Oncology (15 de julho de 2004). «American Society of Clinical Oncology recommendations for the initial hormonal management of androgen-sensitive metastatic, recurrent, or progressive prostate cancer». J Clin Oncol. 22 (14): 2927–41. PMID 15184404 Erratum in: J Clin Oncol. 2004 November 1;22(21):4435.
- ↑ Marcione, Marilyn (12 de outubro de 2011). «Prostate testing's dark side: Men who were harmed». Associated Press. Consultado em 13 de outubro de 2011
- ↑ Djulbegovic M, Beyth RJ, Neuberger MM, Stoffs TL, Vieweg J, Djulbegovic B, Dahm P (2010). «Screening for prostate cancer: systematic review and meta-analysis of randomised controlled trials». BMJ. 341: c4543. PMC 2939952
 . PMID 20843937. doi:10.1136/bmj.c4543
. PMID 20843937. doi:10.1136/bmj.c4543
- ↑ Moyer VA, on behalf of the U.S. Preventive Services Task, Force (maio de 2012). «Screening for Prostate Cancer: U.S. Preventive Services Task Force Recommendation Statement». Annals of Internal Medicine. PMID 22801674
- ↑ «Talking With Your Patients About Screening for Prostate Cancer» (PDF)
- ↑ Chou R, Croswell JM, Dana T, Bougatsos C, Blazina I, Fu R, Gleitsmann K, Koenig HC, Lam C, Maltz A, Rugge JB, Lin K (dezembro de 2011). «Screening for prostate cancer: a review of the evidence for the U.S. Preventive Services Task Force». Annals of Internal Medicine. 155 (11): 762–71. PMID 21984740. doi:10.1059/0003-4819-155-11-201112060-00375
- ↑ Prostate Cancer Screening CDC, atualizado em 6 de abril de 2010
- ↑ Qaseem A, Barry MJ, Denberg TD, Owens DK, Shekelle P (abril de 2013). «Screening for Prostate Cancer: A Guidance Statement From the Clinical Guidelines Committee of the American College of Physicians». Annals of Internal Medicine. 158 (10): 761–9. PMID 23567643. doi:10.7326/0003-4819-158-10-201305210-00633
- ↑ Basch E, Oliver TK, Vickers A, Thompson I, Kantoff P, Parnes H, Loblaw DA, Roth B, Williams J, Nam RK (16 de julho de 2012). «Screening for Prostate Cancer With Prostate-Specific Antigen Testing: American Society of Clinical Oncology Provisional Clinical Opinion» (PDF). Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 30 (24): 3020–5. PMC 3776923
 . PMID 22802323. doi:10.1200/JCO.2012.43.3441
. PMID 22802323. doi:10.1200/JCO.2012.43.3441
- ↑ «EARLY DETECTION OF PROSTATE CANCER: AUA GUIDELINE». American Urological Association. 2013. Consultado em 10 de maio de 2013
- ↑ http://www.cancer.org/docroot/CRI/content/CRI_2_4_2X_What_are_the_risk_factors_for_prostate_cancer_36.asp
- ↑ Jemal, A; Murray T; Ward E; Samuels A; Tiwari RC; Ghafoor A; Feuer EJ; Thun MJ (janeiro–fevereiro de 2005). «Cancer statistics, 2005». CA Cancer J Clin. 55 (1): 10–30. PMID 15661684 Erratum in: CA Cancer J Clin. 2005 Jul-Aug;55(4):259.
- ↑ Wakai, K (fevereiro de 2005). «Descriptive epidemiology of prostate cancer in Japan and Western countries». Nippon Rinsho. 63 (2): 207-12. PMID 15714967 Review. (em japonês)
- ↑ Yeole, BB; Sunny L. junho–dezembro de 2001. «Population based survival from prostate cancer in Mumbai (Bombay), India». Indian J Cancer. 38 (2–4): 126-32. PMID 1259345
- ↑ Hsing, AW; Tsao L, Devesa SS (1 de janeiro de 2000). «International trends and patterns of prostate cancer incidence and mortality». Int J Cancer. 85 (1): 60-7. PMID 10585584
- ↑ Osegbe, DN (abril de 1997). «Prostate cancer in Nigerians: facts and nonfacts». J Urol. 157 (4): 1340–3. PMID 9120935
- ↑ Di Blasio CJ, Rhee AC, Cho D, Scardino PT, Kattan MW (2003). «Predicting clinical end points: treatment nomograms in prostate cancer». Semin Oncol. 30 (5): 567-86. PMID 14571407
- ↑ Huggins C, Steven RE, Hodges CV (1941). «Studies on prostatic cancer». Arch. Surg. 43 (2): 209–223. doi:10.1001/archsurg.1941.01210140043004
- ↑ Hellerstedt BA, Pienta KJ (2002). «The current state of hormonal therapy for prostate cancer». CA Cancer J Clin. 52 (3): 154–79. PMID 12018929. doi:10.3322/canjclin.52.3.154
- ↑ Feldman BJ, Feldman D (outubro de 2001). «The development of androgen-independent prostate cancer». Nature Reviews Cancer. 1 (1): 34–45. PMID 11900250. doi:10.1038/35094009
- ↑ Adams, J. (1853). «The case of scirrhous of the prostate gland with corresponding affliction of the lymphatic glands in the lumbar region and in the pelvis». Lancet. 1
- ↑ Lytton, B. (2001). «Prostate cancer: a brief history and the discovery of hormonal ablation treatment». The Journal of Urology. 165 (6 Pt 1): 1859–62. PMID 11371867. doi:10.1016/S0022-5347(05)66228-3
- ↑ Young, H.H. (1905). «Four cases of radical prostatectomy». Johns Hopkins Bull. 16
- ↑ Walsh, P.C.; Lepor, H.; Eggleston, J.C. (1983). «Radical prostatectomy with preservation of sexual function: anatomical and pathological considerations». The Prostate. 4 (5): 473–85. PMID 6889192. doi:10.1002/pros.2990040506
- ↑ Huggins CB, Hodges CV (1941). «Studies on prostate cancer: 1. The effects of castration, of estrogen and androgen injection on serum phosphatases in metastatic carcinoma of the prostate». Cancer Res. 1
- ↑ Schally AV, Kastin AJ, Arimura A (novembro de 1971). «Hypothalamic follicle-stimulating hormone (FSH) and luteinizing hormone (LH)-regulating hormone: structure, physiology, and clinical studies». Fertility and Sterility. 22 (11): 703–21. PMID 4941683
- ↑ Tolis G, Ackman D, Stellos A, Mehta A, Labrie F, Fazekas AT, Comaru-Schally AM, Schally AV (março de 1982). «Tumor growth inhibition in patients with prostatic carcinoma treated with luteinizing hormone-releasing hormone agonists». Proc. Natl. Acad. Sci. U.S.A. 79 (5): 1658–62. PMC 346035
 . PMID 6461861. doi:10.1073/pnas.79.5.1658
. PMID 6461861. doi:10.1073/pnas.79.5.1658
- ↑ Denmeade SR, Isaacs JT (maio de 2002). «A history of prostate cancer treatment». Nature Reviews Cancer. 2 (5): 389–96. PMID 12044015. doi:10.1038/nrc801
- ↑ «Being active reduces the risk of prostate cancer». Tech Explorist (em inglês). 5 de dezembro de 2019. Consultado em 5 de dezembro de 2019
