Trioxidano
| Trioxidano Alerta sobre risco à saúde | |
|---|---|
| Nome IUPAC | Trioxidane |
| Outros nomes | Dihydrogen trioxide Hydrogen trioxide Water-Air |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| ChEBI | |
| SMILES |
|
| InChI | 1/H2O3/c1-3-2/h1-2H
|
| Referência Gmelin | 200290 |
| Propriedades | |
| Fórmula química | H2O3 |
| Massa molar | 50 g mol-1 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
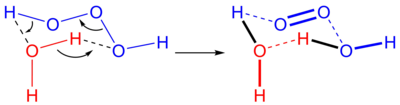
Trioxidano, trióxido de hidrogênio ou trióxido de di-hidrogênio é uma molécula instável de fórmula química H2O3 ou HOOOH. Em solução aquosa trioxidano se decompõe em água e oxigênio singlete:
A reação reversa, a adição de oxigênio singlete à água, tipicamente não ocorre devido à escassez do oxigênio singlete. Em síntese biológica, porém, sabe-se que ozônio é gerado a partir de oxigênio singlete, e o mecanismo presumido é uma produção de trioxidano catalisada por anticorpos.[1]
Preparação
[editar | editar código-fonte]Trioxidano pode ser obtido em quantidades pequenas, porém detectáveis, pela reação entre ozônio e peróxido de hidrogênio, ou pela dissociação elétrica da água. Quantidades maiores foram preparadas a partir de ozônio com agentes redutores orgânicos à baixas temperaturas em variados solventes, também é formado pela decomposição de hidrotrióxidos orgânicos (ROOOH).[2] A reação de ozônio com peróxido de hidrogênio é conhecido como "processo peroxone", essa mistura já foi usada para tratamento de águas subterrâneas contaminadas com compostos orgânicos. Essa reação produz H2O3 e H2O5.[3]
Estrutura
[editar | editar código-fonte]Análise espectroscópica mostra que essa molécula apresenta estrutura linear torcida H-O-O-O-H, e as ligações oxigênio-oxigênio são mais curtas que a do peróxido de hidrogênio. Várias formas diméricas e triméricas também parecem existir. É um pouco mais acídico que o peróxido de hidrogênio,dissociando-se em:H+ e OOOH-.[4]
Reações
[editar | editar código-fonte]Trioxidano se decompõe prontamente em água e oxigênio singlete. Com uma meia vida de aproximadamente 16 minutos em solventes orgânicos À temperatura ambiente, e apenas alguns milissegundos em água. Reage com sulfetos orgânicos para formar sulfóxidos, porém, pouco se sabe sobre sua reatividade.
Pesquisas recentes mostram que trioxidano é o ingrediente ativo responsável pelo efeito microbicida de uma mistura de peróxido de hidrogênio e ozônio. Por esses dois compostos estarem presentes em sistemas biológicos, se discute que anticorpos no corpo humano podem gerar esse poderoso oxidante para combater bactérias invasoras.[1][5] A fonte do composto em sistemas biológicos é a reação entre oxigênio singlete e água (a reação procede em ambas as direções, é claro, de acordo com as concentrações), sendo o oxigênio singlete produzido por células do sistema imunológico.[2][6]
Em 2005 trioxidano foi observado experimentalmente por espectroscopia de micro-ondas em um jato supersônico. A molécula existe em uma conformação trans, com as ligações oxigênio-oxigênio com 142,8 picômetros de comprimento comparado a 146,4 picômetros no peróxido de hidrogênio. A química computacional prediz que moléculas com cadeias maiores de oxigênio podem existir. Com essas evidências espectroscópicas, pode ser iniciada uma procura por esse tipo de molécula no espaço interestelar.
Referências
- ↑ a b Paul T. Nyffeler, Nicholas A. Boyle, Laxman Eltepu, Chi-Huey Wong, Albert Eschenmoser, Richard A. Lerner, Paul Wentworth Jr. (2004). «Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone». Angewandte Chemie International Edition. 43 (35): 4656–4659. PMID 15317003. doi:10.1002/anie.200460457
- ↑ a b Božo Plesničar (2005). «Progress in the Chemistry of Dihydrogen Trioxide (HOOOH)». Acta Chim. Slov. 52: 1–12
- ↑ Xin Xu and William A. Goddard III. Peroxonechemistry:Formation of H2O3 and ring-(HO2)(HO3) from O3/H2O2
- ↑ Kohsuke Suma, Yoshihiro Sumiyoshi, and Yasuki Endo (2005). «The Rotational Spectrum and Structure of HOOOH». J. Am. Chem. Soc. 127 (43): 14998–14999. PMID 16248618. doi:10.1021/ja0556530[ligação inativa]
- ↑ A Time-Honored Chemical Reaction Generates an Unexpected Product, News & Views, September 13, 2004
- ↑ Roald Hoffmann (2004). «The Story of O». American Scientist. Consultado em 3 de janeiro de 2012. Cópia arquivada em 3 de março de 2016