Receptor nicotínico de acetilcolina

Os receptores nicotínicos de acetilcolina, ou nAChRs, são polipeptídeos receptores que respondem ao neurotransmissor acetilcolina. Os receptores nicotínicos também respondem a drogas, como o agonista nicotina. Eles são encontrados no sistema nervoso central e periférico, músculos e em muitos outros tecidos de diversos organismos. Na junção neuromuscular, eles são os principais receptores musculares para a comunicação nervo-músculo motor que controla a contração muscular. No sistema nervoso periférico: (1) eles transmitem sinais de saída das células pré-sinápticas para as células pós-sinápticas no sistema nervoso simpático e parassimpático, e (2) são os receptores encontrados nos músculos esqueléticos que recebem acetilcolina liberada para sinalizar a contração muscular. No sistema imunológico, os nAChRs regulam processos inflamatórios e sinalizam por meio de vias intracelulares distintas[1]. Em insetos, o sistema colinérgico está limitado ao sistema nervoso central[2].
Os receptores nicotínicos são considerados receptores colinérgicos, pois respondem à acetilcolina. Eles recebem o nome da nicotina, que não estimula os receptores muscarínicos de acetilcolina, mas se liga seletivamente aos receptores nicotínicos[3][4]. [5]O receptor muscarínico de acetilcolina, por sua vez, recebe o nome de uma substância química que se liga seletivamente a esse receptor - a muscarina[6]. A acetilcolina em si se liga tanto aos receptores muscarínicos quanto aos receptores nicotínicos de acetilcolina[7].
Como receptores ionotrópicos, os nAChRs estão diretamente ligados a canais iônicos. Novas evidências sugerem que esses receptores também podem usar segundos mensageiros (como fazem os receptores metabotrópicos) em alguns casos[8]. Os receptores nicotínicos de acetilcolina são os mais estudados entre os receptores ionotrópicos[3].
Uma vez que os receptores nicotínicos ajudam na transmissão de sinais de saída para os sistemas simpático e parassimpático, antagonistas dos receptores nicotínicos, como o hexametônio, interferem na transmissão desses sinais. Assim, por exemplo, os antagonistas dos receptores nicotínicos interferem no barorreceptor[9], que normalmente corrige alterações na pressão sanguínea por meio do estímulo simpático e parassimpático do coração.
Estrutura
[editar | editar código-fonte]Os receptores nicotínicos, com uma massa molecular de 290 kDa[10], são compostos por cinco subunidades dispostas simetricamente ao redor de um poro central[3]. Cada subunidade é constituída por quatro domínios transmembranares, sendo que tanto o N-terminal quanto o C-terminal estão localizados extracelularmente. Eles apresentam semelhanças com os receptores GABAA, receptores de glicina e os receptores de serotonina tipo 3 (todos receptores ionotrópicos), ou as proteínas da família Cys-loop[11].
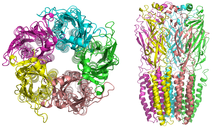
Em vertebrados, os receptores nicotínicos são amplamente classificados em dois subtipos com base em seus principais locais de expressão: receptores nicotínicos do tipo muscular e receptores nicotínicos do tipo neuronal. Nos receptores do tipo muscular, encontrados na junção neuromuscular, os receptores podem ser a forma embrionária, composta pelas subunidades α1, β1, γ e δ numa proporção de 2:1:1:1 ((α1)2β1γδ), ou a forma adulta, composta pelas subunidades α1, β1, δ e ε numa proporção de 2:1:1:1 ((α1)2β1δε)[12][5][4][3]. Os subtipos neuronais são várias combinações homoméricas (todas as subunidades do mesmo tipo) ou heteroméricas (pelo menos uma α e uma β) de doze subunidades diferentes de receptores nicotínicos: α2−α10 e β2−β4. Exemplos de subtipos neuronais incluem: (α4)3(β2)2, (α4)2(β2)3, (α3)2(β4)3, α4α6β3(β2)2, (α7)5, entre outros. Tanto nos receptores do tipo muscular quanto nos do tipo neuronal, as subunidades são muito semelhantes entre si, especialmente nas regiões hidrofóbicas[13].
Diversos estudos de microscopia eletrônica e cristalografia de raios-X forneceram informações estruturais de alta resolução para os nAChRs musculares e neuronais, incluindo seus domínios de ligação[10][14][15][16].
Ligações
[editar | editar código-fonte]Assim como todos os canais iônicos ativados por ligantes, a abertura do poro do canal do nAChR requer a ligação de um mensageiro químico. Diferentes termos são utilizados para se referir às moléculas que se ligam aos receptores, como ligante, agonista ou transmissor. Além do agonista endógeno acetilcolina, agonistas do nAChR incluem nicotina, epibatidina e colina. Antagonistas nicotínicos que bloqueiam o receptor incluem mecamilamina, dihidro-β-eritroidina e hexametonio[13].
Nos nAChRs do tipo muscular, os locais de ligação da acetilcolina estão localizados na interface das subunidades α e ε ou δ. Nos nAChRs neuronais, o local de ligação está na interface de uma subunidade α e uma subunidade β, ou entre duas subunidades α no caso dos receptores α7. O local de ligação está localizado no domínio extracelular próximo ao N-terminal[4]. Quando um agonista se liga ao local, todas as subunidades presentes passam por uma mudança conformacional e o canal é aberto[17], formando um poro com um diâmetro de cerca de 0,65 nm[4].
Canal de abertura
[editar | editar código-fonte]Os receptores nicotínicos de acetilcolina (nAChRs) podem existir em diferentes estados conformacionais interconvertíveis. A ligação de um agonista estabiliza os estados abertos e dessensibilizados. Em condições fisiológicas normais, o receptor precisa exatamente de duas moléculas de ACh para se abrir[18]. A abertura do canal permite que íons positivamente carregados o atravessem; em particular, o sódio entra na célula e o potássio sai. O fluxo líquido de íons positivamente carregados é para dentro.
O nAChR é um canal de cátions não seletivo, o que significa que vários íons positivamente carregados diferentes podem passar por ele[3]. É permeável a Na+ e K+, com algumas combinações de subunidades que também são permeáveis a Ca2+[4][19][20]. A quantidade de sódio e potássio que os canais permitem através de seus poros (sua condutância) varia de 50 a 110 pS, com a condutância dependendo da composição específica da subunidade, bem como do íon permeante[21].
Muitos nAChRs neuronais podem afetar a liberação de outros neurotransmissores[5]. O canal geralmente se abre rapidamente e tende a permanecer aberto até que o agonista se difunda, o que geralmente leva cerca de 1 milissegundo[4]. Os nAChRs podem se abrir espontaneamente sem ligantes ligados ou podem se fechar espontaneamente com ligantes ligados, e mutações no canal podem alterar a probabilidade de qualquer um desses eventos[22][18]. Portanto, a ligação da ACh muda a probabilidade de abertura do poro, que aumenta à medida que mais ACh se liga.
O nAChR é incapaz de se ligar à ACh quando está ligado a qualquer uma das α-neurotoxinas do veneno de cobra. Essas α-neurotoxinas se ligam de maneira antagônica, apertada e não covalente aos nAChRs dos músculos esqueléticos e dos neurônios, bloqueando assim a ação da ACh na membrana pós-sináptica, inibindo o fluxo iônico e levando à paralisia e morte. O nAChR contém dois locais de ligação para neurotoxinas do veneno de cobra. O progresso na descoberta da dinâmica da ação de ligação desses locais tem sido difícil, embora estudos recentes usando dinâmica de modo normal tenham ajudado a prever a natureza dos mecanismos de ligação tanto das toxinas de cobra quanto da ACh nos nAChRs[23]. Esses estudos mostraram que um movimento semelhante a um torção causado pela ligação da ACh provavelmente é responsável pela abertura do poro, e que uma ou duas moléculas de α-bungarotoxina (ou outra α-neurotoxina de cadeia longa) são suficientes para interromper esse movimento. As toxinas parecem unir entre si subunidades vizinhas do receptor, inibindo a torção e, portanto, o movimento de abertura[24].
Efeitos
[editar | editar código-fonte]A ativação de receptores pela nicotina modifica o estado dos neurônios por meio de dois mecanismos principais. Por um lado, o movimento de cátions provoca uma despolarização da membrana plasmática (resultando em um potencial pós-sináptico excitatório nos neurônios), levando à ativação de canais iônicos dependentes de voltagem. Por outro lado, a entrada de cálcio atua, seja diretamente ou indiretamente, em diferentes cascata intracelulares. Isso leva, por exemplo, à regulação da atividade de alguns genes ou à liberação de neurotransmissores.
Regulação
[editar | editar código-fonte]Desensibilização
A desensibilização ligante-dependente de receptores foi caracterizada pela primeira vez por Katz e Thesleff no receptor nicotínico de acetilcolina[25].
A exposição prolongada ou repetida a um estímulo frequentemente resulta em uma diminuição na responsividade desse receptor a um estímulo, denominada desensibilização. A função do nAChR pode ser modulada por meio de fosforilação, por meio da ativação de quinases de proteínas dependentes de mensageiros secundários. PKA[26] e PKC[27], bem como quinases de tirosina[28], foram demonstradas fosforilar o nAChR, resultando em sua desensibilização[26]. Foi relatado que, após uma exposição prolongada do receptor ao agonista, o próprio agonista causa uma mudança conformacional induzida por agonista no receptor, resultando na desensibilização do receptor[29].
Receptores dessensibilizados podem retornar a um estado prolongado aberto quando um agonista está ligado na presença de um modulador alostérico positivo, como o PNU-120,596[30]. Além disso, há evidências que indicam que moléculas específicas de chaperona têm efeitos regulatórios sobre esses receptores[31].
Funções
[editar | editar código-fonte]As subunidades dos receptores nicotínicos pertencem a uma família de múltiplos genes (16 membros em humanos), e a montagem de combinações de subunidades resulta em um grande número de receptores diferentes (para mais informações, consulte o banco de dados de Canais Iônicos Ativados por Ligantes). Esses receptores, com propriedades cinéticas, eletrofisiológicas e farmacológicas altamente variáveis, respondem à nicotina de maneiras diferentes, em concentrações efetivas muito diversas. Essa diversidade funcional permite que participem de dois grandes tipos de neurotransmissão. A transmissão sináptica clássica (transmissão com fio) envolve a liberação de altas concentrações de neurotransmissores, agindo imediatamente sobre receptores vizinhos. Em contraste, a transmissão parácrina (transmissão de volume) envolve neurotransmissores liberados pelos terminais axonais, que então se difundem pelo meio extracelular até atingirem seus receptores, que podem estar distantes[32]. Os receptores nicotínicos também podem ser encontrados em diferentes locais sinápticos; por exemplo, o receptor nicotínico muscular sempre funciona pós-sinapticamente. As formas neuronais do receptor podem ser encontradas tanto pós-sinapticamente (envolvidas na neurotransmissão clássica) quanto pré-sinapticamente[33], onde podem influenciar a liberação de múltiplos neurotransmissores.
Subunidades
[editar | editar código-fonte]Foram identificadas 17 subunidades de nAChR em vertebrados, que são divididas em subunidades do tipo muscular e do tipo neuronal. Embora uma subunidade/gene α8 esteja presente em espécies aviárias como o frango, ela não está presente em espécies humanas ou mamíferas[34].
As subunidades de nAChR foram divididas em 4 subfamílias (I–IV) com base em similaridades na sequência de proteínas[35]. Além disso, a subfamília III foi ainda dividida em 3 tipos.
Subunidades α: CHRNA1 (muscular), CHRNA2 (neuronal), CHRNA3, CHRNA4, CHRNA5, CHRNA6, CHRNA7, CHRNA8, CHRNA9, CHRNA10
Subunidades β: CHRNB1 (muscular), CHRNB2 (neuronal), CHRNB3, CHRNB4 ]
Outras subunidades: CHRND (delta), CHRNE (epsilon), CHRNG (gamma)
Os receptores nicotínicos neuronais são proteínas transmembranares que formam estruturas pentaméricas montadas a partir de uma família de subunidades compostas por α2–α10 e β2–β4. Essas subunidades foram descobertas de meados dos anos 1980 até o início dos anos 1990, quando cDNAs para múltiplas subunidades de nAChR foram clonadas de cérebros de ratos e galinhas, levando à identificação de onze genes diferentes (doze em galinhas) que codificam subunidades neuronais de nAChR. Os genes de subunidade identificados foram nomeados α2–α10 (α8 encontrado apenas em galinhas) e β2–β4[36]. Descobriu-se também que várias combinações de subunidades podem formar nAChRs funcionais que podem ser ativados por acetilcolina e nicotina, e diferentes combinações de subunidades geram subtipos de nAChRs com propriedades funcionais e farmacológicas diversas[34]. Quando expressas isoladamente, α7, α8, α9 e α10 são capazes de formar receptores funcionais, mas outras subunidades α requerem a presença de subunidades β para formar receptores funcionais[37]. Em mamíferos, subunidades de nAChR foram encontradas codificadas por 17 genes, e desses, nove genes codificando α-subunidades e três codificando β-subunidades são expressos no cérebro. Os nAChRs contendo a subunidade β2 (nAChRs β2) e os nAChRs α7 são amplamente expressos no cérebro, enquanto outras subunidades de nAChR têm expressão mais restrita[38]. A montagem pentamérica de nAChRs é sujeita às subunidades que são produzidas em vários tipos de células, como no pulmão humano, onde pentâmeros epiteliais e musculares diferem significativamente[39].
Genes CHRNA5/A3/B4
Um importante conjunto de genes de nAchR (CHRNA5/A3/B4) contém os genes que codificam as subunidades α5, α3 e β4. Estudos genéticos identificaram polimorfismos de nucleotídeo único (SNPs) no locus cromossômico que codifica esses três genes de nAChR como fatores de risco para dependência de nicotina, câncer de pulmão, doença pulmonar obstrutiva crônica, alcoolismo e doença arterial periférica[37]. Os genes de subunidades CHRNA5/A3/B4 nAChR estão localizados em um agrupamento apertado na região cromossômica 15q24–25. As subunidades de nAChR codificadas por esse locus formam os subtipos predominantes de receptores nicotínicos expressos no sistema nervoso periférico (SNP) e em outros locais-chave do sistema nervoso central (SNC), como a habênula medial, uma estrutura entre o prosencéfalo límbico e o mesencéfalo envolvida em importantes vias de circuitos colinérgicos[37]. Pesquisas adicionais sobre os genes CHRNA5/A3/B4 revelaram que os genes de nAChR "neuronais" também são expressos em células não neuronais, onde estão envolvidos em vários processos fundamentais, como inflamação[40]. Os genes CHRNA5/A3/B4 são coexpressos em muitos tipos de células, e as atividades transcricionais das regiões promotoras dos três genes são reguladas por muitos dos mesmos fatores de transcrição, demonstrando que seu agrupamento pode refletir o controle da expressão gênica[37].
Genes CHRNA6/CHRNB3
CHRNB3 e CHRNA6 também estão agrupados em um conjunto de genes, localizado no 8p11[41]. Vários estudos mostraram que SNPs no CHRNB3–CHRNA6 estão relacionados à dependência de nicotina e comportamento de fumar, como dois SNPs em CHRNB3, rs6474413 e rs10958726[41]. A variação genética nessa região também exerce influência na suscetibilidade ao uso de drogas, incluindo cocaína e consumo de álcool[42]. Receptores nicotínicos contendo subunidades α6 ou β3 expressas em regiões cerebrais, especialmente na área tegmental ventral e substância negra, são importantes para comportamentos relacionados a drogas devido ao seu papel na liberação de dopamina[43]. A variação genética nesses genes pode alterar a sensibilidade a drogas de abuso de várias maneiras, incluindo mudanças na estrutura do aminoácido da proteína ou causar alterações na regulação transcricional e traducional[42].
Genes CHRNA4/CHRNB2
Outros genes de nAChR bem estudados incluem CHRNA4 e CHRNB2, que foram associados como genes de Epilepsia Frontal Noturna Autossômica Dominante (ADNFLE)[41][44]. Ambas essas subunidades de nAChR estão presentes no cérebro, e a ocorrência de mutações nessas duas subunidades causa um tipo generalizado de epilepsia. Exemplos incluem a mutação de inserção CHRNA4 776ins3, associada a convulsões noturnas e transtornos psiquiátricos, e a mutação CHRNB2 I312M, que parece causar não apenas epilepsia, mas também déficits cognitivos muito específicos, como déficits em aprendizado e memória[44][45]. Existe variação genética natural entre esses dois genes, e a análise de polimorfismos de nucleotídeo único (SNPs) e outras modificações genéticas mostra uma maior variação no gene CHRNA4 do que no gene CHRNB2, implicando que a subunidade de nAChR β2, a proteína codificada por CHRNB2, se associa a mais subunidades do que α4. CHRNA2 também foi relatado como um terceiro candidato para convulsões frontais noturnas[44][41].
Gene CHRNA7
Vários estudos relataram uma associação entre CHRNA7 e endofenótipos de transtornos psiquiátricos e dependência de nicotina, contribuindo para a relevância clínica significativa de α7 e para a pesquisa realizada sobre ela[44]. CHRNA7 foi um dos primeiros genes considerados envolvidos na esquizofrenia. Estudos identificaram várias polimorfias no promotor CHRNA7 que reduzem a atividade transcricional dos genes, associadas à esquizofrenia, o que é consistente com a descoberta de níveis reduzidos de nAChRs a7 no cérebro de pacientes esquizofrênicos[44]. Ambos os subtipos de nAChRs, α4β2 e α7, foram encontrados significativamente reduzidos em estudos post-mortem de indivíduos com esquizofrenia[46]. Além disso, as taxas de tabagismo são significativamente mais altas em pessoas com esquizofrenia, implicando que fumar nicotina pode ser uma forma de automedicação[47].
Variações notáveis
Os receptores nicotínicos são pentâmeros dessas subunidades; ou seja, cada receptor contém cinco subunidades. Portanto, existe um potencial imenso de variação dessas subunidades, algumas das quais são mais comumente encontradas do que outras. Os subtipos mais amplamente expressos incluem (α1)2β1δε (tipo muscular adulto), (α3)2(β4)3 (tipo ganglionar), (α4)2(β2)3 (tipo SNC) e (α7)5 (outro tipo SNC).
Referências
- ↑ Lu, Ben; Kwan, Kevin; Levine, Yaakov A.; Olofsson, Peder S.; Yang, Huan; Li, Jianhua; Joshi, Sonia; Wang, Haichao; Andersson, Ulf (janeiro de 2014). «α7 Nicotinic Acetylcholine Receptor Signaling Inhibits Inflammasome Activation by Preventing Mitochondrial DNA Release». Molecular Medicine (em inglês) (1): 350–358. ISSN 1076-1551. doi:10.2119/molmed.2013.00117. Consultado em 21 de dezembro de 2023
- ↑ Yamamoto, Izuru (1999). Yamamoto, Izuru; Casida, John E., eds. «Nicotine to Nicotinoids: 1962 to 1997». Tokyo: Springer Japan (em inglês): 3–27. ISBN 978-4-431-67933-2. doi:10.1007/978-4-431-67933-2_1. Consultado em 21 de dezembro de 2023
- ↑ a b c d e «APA PsycNet». psycnet.apa.org (em inglês). Consultado em 21 de dezembro de 2023
- ↑ a b c d e f Olsen, Richard W.; DeLorey, Timothy M. (1999). «GABA Receptor Physiology and Pharmacology». Lippincott-Raven (em inglês). Consultado em 21 de dezembro de 2023
- ↑ a b c Itier, Valérie; Bertrand, Daniel (31 de agosto de 2001). «Neuronal nicotinic receptors: from protein structure to function». FEBS Letters (em inglês) (3): 118–125. ISSN 0014-5793. doi:10.1016/S0014-5793(01)02702-8. Consultado em 21 de dezembro de 2023
- ↑ Ishii, Masaru; Kurachi, Yoshihisa. «Muscarinic Acetylcholine Receptors». Current Pharmaceutical Design (em inglês) (28): 3573–3581. Consultado em 21 de dezembro de 2023
- ↑ Lott, Erica L.; Jones, Elizabeth B. (2023). «Cholinergic Toxicity». Treasure Island (FL): StatPearls Publishing. PMID 30969605. Consultado em 21 de dezembro de 2023
- ↑ Kabbani, Nadine; Nordman, Jacob C.; Corgiat, Brian A.; Veltri, Daniel P.; Shehu, Amarda; Seymour, Victoria A.; Adams, David J. (dezembro de 2013). «Are nicotinic acetylcholine receptors coupled to G proteins?». BioEssays (em inglês) (12): 1025–1034. ISSN 0265-9247. doi:10.1002/bies.201300082. Consultado em 21 de dezembro de 2023
- ↑ Henderson, C G; Ungar, A (abril de 1978). «Effect of cholinergic antagonists on sympathetic ganglionic transmission of vasomotor reflexes from the carotid baroreceptors and chemoreceptors of the dog.». The Journal of Physiology (em inglês) (1): 379–385. ISSN 0022-3751. PMC PMC1282395
 Verifique
Verifique |pmc=(ajuda). PMID 206690. doi:10.1113/jphysiol.1978.sp012278. Consultado em 21 de dezembro de 2023 - ↑ a b Unwin, Nigel (4 de março de 2005). «Refined Structure of the Nicotinic Acetylcholine Receptor at 4Å Resolution». Journal of Molecular Biology (4): 967–989. ISSN 0022-2836. doi:10.1016/j.jmb.2004.12.031. Consultado em 21 de dezembro de 2023
- ↑ «Redirecting». linkinghub.elsevier.com. Consultado em 21 de dezembro de 2023
- ↑ «Redirecting». linkinghub.elsevier.com. Consultado em 21 de dezembro de 2023
- ↑ a b Matera, Carlo; Papotto, Claudio; Dallanoce, Clelia; De Amici, Marco (1 de agosto de 2023). «Advances in small molecule selective ligands for heteromeric nicotinic acetylcholine receptors». Pharmacological Research. 106813 páginas. ISSN 1043-6618. doi:10.1016/j.phrs.2023.106813. Consultado em 21 de dezembro de 2023
- ↑ Brejc, KatjuS̆a; Van Dijk, Willem J.; Klaassen, Remco V.; Schuurmans, Mascha; Van Der Oost, John; Smit, August B.; Sixma, Titia K. (17 de maio de 2001). «Crystal structure of an ACh-binding protein reveals the ligand-binding domain of nicotinic receptors». Nature (em inglês) (6835): 269–276. ISSN 0028-0836. doi:10.1038/35077011. Consultado em 21 de dezembro de 2023
- ↑ www.semanticscholar.org https://www.semanticscholar.org/paper/Crystal-structures-of-free-and-antagonist-bound-of-Zouridakis-Giastas/b0f29b071fa54e100de3f3ebd6b8135882c00512. Consultado em 21 de dezembro de 2023 Em falta ou vazio
|título=(ajuda) - ↑ Morales-Perez, Claudio L.; Noviello, Colleen M.; Hibbs, Ryan E. (outubro de 2016). «X-ray structure of the human α4β2 nicotinic receptor». Nature (em inglês) (7625): 411–415. ISSN 1476-4687. doi:10.1038/nature19785. Consultado em 21 de dezembro de 2023
- ↑ Colquhoun, David; Sivilotti, Lucia G. (junho de 2004). «Function and structure in glycine receptors and some of their relatives». Trends in Neurosciences (6): 337–344. ISSN 0166-2236. PMID 15165738. doi:10.1016/j.tins.2004.04.010. Consultado em 21 de dezembro de 2023
- ↑ a b «The physiology of excitable cells | WorldCat.org». search.worldcat.org. Consultado em 21 de dezembro de 2023
- ↑ Beker, Friederike; Weber, Martin; Fink, Rainer H. A.; Adams, David J. (setembro de 2003). «Muscarinic and Nicotinic ACh Receptor Activation Differentially Mobilize Ca 2 + in Rat Intracardiac Ganglion Neurons». Journal of Neurophysiology (em inglês) (3): 1956–1964. ISSN 0022-3077. doi:10.1152/jn.01079.2002. Consultado em 21 de dezembro de 2023
- ↑ Weber, Martin; Motin, Leonid; Gaul, Simon; Beker, Friederike; Fink, Rainer H A; Adams, David J (janeiro de 2005). «Intravenous anaesthetics inhibit nicotinic acetylcholine receptor‐mediated currents and Ca 2+ transients in rat intracardiac ganglion neurons». British Journal of Pharmacology (em inglês) (1): 98–107. ISSN 0007-1188. PMC PMC1575970
 Verifique
Verifique |pmc=(ajuda). PMID 15644873. doi:10.1038/sj.bjp.0705942. Consultado em 21 de dezembro de 2023 - ↑ Mishina, Masayoshi; Takai, Toshiyuki; Imoto, Keiji; Noda, Masaharu; Takahashi, Tomoyuki; Numa, Shosaku; Methfessel, Christoph; Sakmann, Bert (maio de 1986). «Molecular distinction between fetal and adult forms of muscle acetylcholine receptor». Nature (em inglês) (6068): 406–411. ISSN 1476-4687. doi:10.1038/321406a0. Consultado em 21 de dezembro de 2023
- ↑ Einav, Tal; Phillips, Rob (20 de abril de 2017). «Monod-Wyman-Changeux Analysis of Ligand-Gated Ion Channel Mutants». The Journal of Physical Chemistry B (em inglês) (15): 3813–3824. ISSN 1520-6106. PMC PMC5551692
 Verifique
Verifique |pmc=(ajuda). PMID 28134524. doi:10.1021/acs.jpcb.6b12672. Consultado em 21 de dezembro de 2023 - ↑ Levitt, Michael; Sander, Christian; Stern, Peter S. (5 de fevereiro de 1985). «Protein normal-mode dynamics: Trypsin inhibitor, crambin, ribonuclease and lysozyme». Journal of Molecular Biology (3): 423–447. ISSN 0022-2836. doi:10.1016/0022-2836(85)90230-X. Consultado em 21 de dezembro de 2023
- ↑ Samson, Abraham O.; Levitt, Michael (1 de abril de 2008). «Inhibition Mechanism of the Acetylcholine Receptor by α-Neurotoxins as Revealed by Normal-Mode Dynamics». Biochemistry (em inglês) (13): 4065–4070. ISSN 0006-2960. PMC PMC2750825
 Verifique
Verifique |pmc=(ajuda). PMID 18327915. doi:10.1021/bi702272j. Consultado em 21 de dezembro de 2023 - ↑ Pitchford, S.; Day, J. W.; Gordon, A.; Mochly-Rosen, D. (1 de novembro de 1992). «Nicotinic acetylcholine receptor desensitization is regulated by activation-induced extracellular adenosine accumulation». Journal of Neuroscience (em inglês) (11): 4540–4544. ISSN 0270-6474. PMID 1331363. doi:10.1523/JNEUROSCI.12-11-04540.1992. Consultado em 21 de dezembro de 2023
- ↑ a b Huganir, Richard L.; Greengard, Paul (fevereiro de 1983). «cAMP-dependent protein kinase phosphorylates the nicotinic acetylcholine receptor». Proceedings of the National Academy of Sciences (em inglês) (4): 1130–1134. ISSN 0027-8424. PMC PMC393542
 Verifique
Verifique |pmc=(ajuda). PMID 6302672. doi:10.1073/pnas.80.4.1130. Consultado em 21 de dezembro de 2023 - ↑ Huganir, Richard L.; Greengard, Paul (1 de fevereiro de 1983). «cAMP-Dependent Protein Kinase Phosphorylates the Nicotinic Acetylcholine Receptor». Proceedings of the National Academy of Science: 1130–1134. ISSN 0027-8424. doi:10.1073/pnas.80.4.1130. Consultado em 21 de dezembro de 2023
- ↑ Hopfield, Jessica F.; Tank, David W.; Greengard, Paul; Huganir, Richard L. (dezembro de 1988). «Functional modulation of the nicotinic acetylcholine receptor by tyrosine phosphorylation». Nature (em inglês) (6200): 677–680. ISSN 0028-0836. doi:10.1038/336677a0. Consultado em 21 de dezembro de 2023
- ↑ Barrantes, F. J. (5 de setembro de 1978). «Agonist-mediated changes of the acetylcholine receptor in its membrane environment». Journal of Molecular Biology (1): 1–26. ISSN 0022-2836. doi:10.1016/0022-2836(78)90144-4. Consultado em 21 de dezembro de 2023
- ↑ Hurst, Raymond S.; Hajós, Mihaly; Raggenbass, Mario; Wall, Theron M.; Higdon, Nicole R.; Lawson, Judy A.; Rutherford-Root, Karen L.; Berkenpas, Mitchell B.; Hoffmann, W. E. (27 de abril de 2005). «A Novel Positive Allosteric Modulator of the α7 Neuronal Nicotinic Acetylcholine Receptor: In Vitro and In Vivo Characterization». Journal of Neuroscience (em inglês) (17): 4396–4405. ISSN 0270-6474. PMC PMC6725110
 Verifique
Verifique |pmc=(ajuda). PMID 15858066. doi:10.1523/JNEUROSCI.5269-04.2005. Consultado em 21 de dezembro de 2023 - ↑ Sadigh-Eteghad, Saeed; Majdi, Alireza; Talebi, Mahnaz; Mahmoudi, Javad; Babri, Shirin (15 de maio de 2015). «Regulation of nicotinic acetylcholine receptors in Alzheimer׳s disease: A possible role of chaperones». European Journal of Pharmacology: 34–41. ISSN 0014-2999. doi:10.1016/j.ejphar.2015.02.047. Consultado em 21 de dezembro de 2023
- ↑ Picciotto, Marina R.; Higley, Michael J.; Mineur, Yann S. (4 de outubro de 2012). «Acetylcholine as a neuromodulator: cholinergic signaling shapes nervous system function and behavior». Neuron (1): 116–129. ISSN 1097-4199. PMC 3466476
 . PMID 23040810. doi:10.1016/j.neuron.2012.08.036. Consultado em 21 de dezembro de 2023
. PMID 23040810. doi:10.1016/j.neuron.2012.08.036. Consultado em 21 de dezembro de 2023
- ↑ Wonnacott, Susan (fevereiro de 1997). «Presynaptic nicotinic ACh receptors». Trends in Neurosciences (em inglês) (2): 92–98. doi:10.1016/S0166-2236(96)10073-4. Consultado em 21 de dezembro de 2023
- ↑ a b Graham, A.; Court, J. A.; Martin-Ruiz, C. M.; Jaros, E.; Perry, R.; Volsen, S. G.; Bose, S.; Evans, N.; Ince, P. (2002). «Immunohistochemical localisation of nicotinic acetylcholine receptor subunits in human cerebellum». Neuroscience (3): 493–507. ISSN 0306-4522. PMID 12150770. doi:10.1016/s0306-4522(02)00223-3. Consultado em 21 de dezembro de 2023
- ↑ Le Novere, Nicolas; Changeux, Jean-Pierre (1 de fevereiro de 1995). «Molecular evolution of the nicotinic acetylcholine receptor: An example of multigene family in excitable cells». Journal of Molecular Evolution (em inglês) (2): 155–172. ISSN 1432-1432. doi:10.1007/BF00167110. Consultado em 21 de dezembro de 2023
- ↑ Tammimäki, Anne; Horton, William J.; Stitzel, Jerry A. (15 de outubro de 2011). «Recent advances in gene manipulation and nicotinic acetylcholine receptor biology». Biochemical Pharmacology (8): 808–819. ISSN 1873-2968. PMC 3162071
 . PMID 21704022. doi:10.1016/j.bcp.2011.06.014. Consultado em 21 de dezembro de 2023
. PMID 21704022. doi:10.1016/j.bcp.2011.06.014. Consultado em 21 de dezembro de 2023
- ↑ a b c d Improgo, Ma. Reina D.; Scofield, Michael D.; Tapper, Andrew R.; Gardner, Paul D. (1 de outubro de 2010). «The nicotinic acetylcholine receptor CHRNA5/A3/B4 gene cluster: Dual role in nicotine addiction and lung cancer». Progress in Neurobiology (2): 212–226. ISSN 0301-0082. doi:10.1016/j.pneurobio.2010.05.003. Consultado em 21 de dezembro de 2023
- ↑ Changeux, Jean-Pierre (junho de 2010). «Nicotine addiction and nicotinic receptors: lessons from genetically modified mice». Nature Reviews. Neuroscience (6): 389–401. ISSN 1471-0048. PMID 20485364. doi:10.1038/nrn2849. Consultado em 21 de dezembro de 2023
- ↑ Diabasana, Zania; Perotin, Jeanne-Marie; Belgacemi, Randa; Ancel, Julien; Mulette, Pauline; Delepine, Gonzague; Gosset, Philippe; Maskos, Uwe; Polette, Myriam (9 de outubro de 2020). «Nicotinic Receptor Subunits Atlas in the Adult Human Lung». International Journal of Molecular Sciences (20). 7446 páginas. ISSN 1422-0067. PMC 7588933
 . PMID 33050277. doi:10.3390/ijms21207446. Consultado em 21 de dezembro de 2023
. PMID 33050277. doi:10.3390/ijms21207446. Consultado em 21 de dezembro de 2023
- ↑ Gahring, Lorise C.; Rogers, Scott W. (13 de janeiro de 2006). «Neuronal nicotinic acetylcholine receptor expression and function on nonneuronal cells». The AAPS journal (4): E885–894. ISSN 1550-7416. PMC 2750958
 . PMID 16594641. doi:10.1208/aapsj070486. Consultado em 21 de dezembro de 2023
. PMID 16594641. doi:10.1208/aapsj070486. Consultado em 21 de dezembro de 2023
- ↑ a b c d Greenbaum, L.; Lerer, B. (outubro de 2009). «Differential contribution of genetic variation in multiple brain nicotinic cholinergic receptors to nicotine dependence: recent progress and emerging open questions». Molecular Psychiatry (10): 912–945. ISSN 1476-5578. PMID 19564872. doi:10.1038/mp.2009.59. Consultado em 21 de dezembro de 2023
- ↑ a b Kamens, Helen M.; Corley, Robin P.; Richmond, Phillip A.; Darlington, Todd M.; Dowell, Robin; Hopfer, Christian J.; Stallings, Michael C.; Hewitt, John K.; Brown, Sandra A. (setembro de 2016). «Evidence for Association Between Low Frequency Variants in CHRNA6/CHRNB3 and Antisocial Drug Dependence». Behavior Genetics (5): 693–704. ISSN 1573-3297. PMC 4975622
 . PMID 27085880. doi:10.1007/s10519-016-9792-4. Consultado em 21 de dezembro de 2023
. PMID 27085880. doi:10.1007/s10519-016-9792-4. Consultado em 21 de dezembro de 2023
- ↑ Grady, Sharon R.; Salminen, Outi; Laverty, Duncan C.; Whiteaker, Paul; McIntosh, J. Michael; Collins, Allan C.; Marks, Michael J. (15 de outubro de 2007). «The subtypes of nicotinic acetylcholine receptors on dopaminergic terminals of mouse striatum». Biochemical Pharmacology (8): 1235–1246. ISSN 0006-2952. PMC 2735219
 . PMID 17825262. doi:10.1016/j.bcp.2007.07.032. Consultado em 21 de dezembro de 2023
. PMID 17825262. doi:10.1016/j.bcp.2007.07.032. Consultado em 21 de dezembro de 2023
- ↑ a b c d e Steinlein, O. K.; Bertrand, D. (15 de novembro de 2008). «Neuronal nicotinic acetylcholine receptors: from the genetic analysis to neurological diseases». Biochemical Pharmacology (10): 1175–1183. ISSN 1873-2968. PMID 18691557. doi:10.1016/j.bcp.2008.07.012. Consultado em 21 de dezembro de 2023
- ↑ Bertrand, Daniel; Elmslie, Frances; Hughes, Elaine; Trounce, John; Sander, Thomas; Bertrand, Sonia; Steinlein, Ortrud K. (dezembro de 2005). «The CHRNB2 mutation I312M is associated with epilepsy and distinct memory deficits». Neurobiology of Disease (3): 799–804. ISSN 0969-9961. PMID 15964197. doi:10.1016/j.nbd.2005.05.013. Consultado em 21 de dezembro de 2023
- ↑ Breese, C. R.; Lee, M. J.; Adams, C. E.; Sullivan, B.; Logel, J.; Gillen, K. M.; Marks, M. J.; Collins, A. C.; Leonard, S. (outubro de 2000). «Abnormal regulation of high affinity nicotinic receptors in subjects with schizophrenia». Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology (4): 351–364. ISSN 0893-133X. PMID 10989262. doi:10.1016/S0893-133X(00)00121-4. Consultado em 21 de dezembro de 2023
- ↑ McLean, Samantha L.; Grayson, Ben; Idris, Nagi F.; Lesage, Anne S.; Pemberton, Darrel J.; Mackie, Claire; Neill, Jo C. (abril de 2011). «Activation of α7 nicotinic receptors improves phencyclidine-induced deficits in cognitive tasks in rats: implications for therapy of cognitive dysfunction in schizophrenia». European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology (4): 333–343. ISSN 1873-7862. PMID 20630711. doi:10.1016/j.euroneuro.2010.06.003. Consultado em 21 de dezembro de 2023
