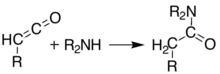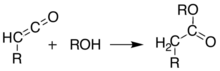Ácido de Meldrum
O ácido de Meldrum ou 2,2-dimetil-1,3-dioxano-4,6-diona é um composto orgânico de fórmula C6H8O4. Sua molécula possui um núcleo heterocíclico com quatro átomos de carbono e dois de oxigênio; a fórmula também pode ser escrita como [−O−(C(CH3)2)−O−(C=O)−(CH2)−(C=O)−]
| Ácido de Meldrum Alerta sobre risco à saúde | |
|---|---|

| |
| Nome IUPAC | 2,2-Dimetil-1,3-dioxane-4,6-diona |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | C6H8O4 |
| Massa molar | 144,126 g·mol−1 |
| Ponto de fusão |
94 a 95 °C ( 367 a 368 K) (decompõe-se) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
É um sólido incolor cristalino, pouco solúvel em água. Decompõe-se no aquecimento com liberação de dióxido de carbono e acetona.[1][2]
Propriedades[editar | editar código-fonte]
Acidez[editar | editar código-fonte]
O composto pode facilmente perder um íon hidrogênio do elemento metileno CH2 no anel (carbono 5); que cria uma ligação dupla entre ele e um dos carbonos adjacentes (número 4 ou 6) e uma carga negativa no oxigênio correspondente. O ânion resultante é estabilizado por ressonância entre as duas alternativas, de modo que a ligação dupla é deslocalizada e cada oxigênio nos carbonilos tem uma carga formal de -1/2.

A constante de ionização do ácido de Meldrum pKa é 4,97; da mesma magnitude que os ácidos carboxílicos, a dimedona e o ácido barbitúrico. No entanto, enquanto dimedona existe em solução predominantemente como o mono enol tautômero, ácido de Meldrum é quase inteiramente como a dicetona forma.
A alta acidez deste composto foi considerada anômala por muito tempo é 8 ordens de magnitude mais ácida que o malonato de dimetilo . Em 2004, Ohwada e colegas de trabalho determinaram que a estrutura de conformação que minimiza a energia coloca o orbital σ CH do próton alfa na geometria adequada para se alinhar com o π * CO, de modo que o estado fundamental apresenta uma desestabilização incomumente forte da ligação CH.[3]
Preparação[editar | editar código-fonte]
Síntese original[editar | editar código-fonte]
O composto foi produzido pela primeira vez por Meldrum por uma reação de condensação de acetona com ácido malônico em anidrido acético e ácido sulfúrico .[2]

Sínteses alternativas[editar | editar código-fonte]
Como alternativa à sua preparação original, o ácido de Meldrum pode ser sintetizado a partir de ácido malônico, acetato de isopropenil (um derivado enol da acetona) e ácido sulfúrico catalítico.
Usos[editar | editar código-fonte]
Como o ácido malônico e seus derivados éster, e outros compostos 1,3-dicarbonil, o ácido de Meldrum pode e serve como reagente para uma variedade de reações nucleofílicas .
Alquilação e acilação[editar | editar código-fonte]
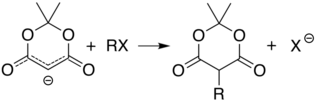
A acidez do carbono entre os dois grupos carbonila permite alquilação e acilação simples do ácido de Meldrum nessa posição. Por exemplo, a desprotonação e a reação com um halogeneto de alquila simples ( R−Cl ) anexa o grupo alquil ( R− ) nessa posição:
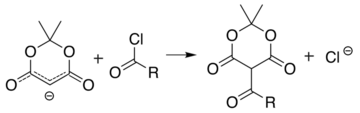
A reação análoga com um cloreto de acila ( R−(C=O)−Cl ) liga o acila ( R−(C=O)− ) ao invés:
Essas duas reações permitem que o ácido de Meldrum sirva de suporte para a síntese de muitas estruturas diferentes com vários grupos funcionais. Os produtos alquilados podem ser ainda manipulados para produzir vários compostos amida e éster. O aquecimento do produto acil na presença de um álcool leva à troca e descarboxilação do éster em um processo semelhante à síntese do éster malônico . A natureza reativa do diéster cíclico permite boa reatividade mesmo para álcoois tão prejudicados quanto o t- butanol .[4] Cetoésteres deste tipo são úteis na síntese de pirrol de Knorr.
Síntese de cetenos[editar | editar código-fonte]
A temperaturas superiores a 200° C[5] O ácido de Meldrum sofre uma reação pericíclica que libera acetona e dióxido de carbono e produz um composto ceteno altamente reativo:[6]

Estes cetenos podem ser isolados usando pirólise a vácuo flash (FVP). Os cetenos são altamente eletrofílicos e podem sofrer reação de adição com outros produtos químicos. Com essa abordagem, é possível formar novas ligações, anéis, amidas, ésteres e ácidos de C-C:
Alternativamente, a pirólise pode ser realizada em solução, para obter os mesmos resultados sem isolar o ceteno, em uma reação de uma panela . A capacidade de formar produtos tão diversos faz do ácido de Meldrum um reagente muito útil para químicos sintéticos.[7][8][9]
Referências
- ↑ «Meldrum's acid». Chemical Society Reviews. 7: 345–358. 1978. doi:10.1039/CS9780700345
- ↑ a b «A β-lactonic acid from acetone and malonic acid». Journal of the Chemical Society, Transactions. 93: 598–601. 1908. doi:10.1039/CT9089300598
- ↑ «Rationale for the Acidity of Meldrum's Acid. Consistent Relation of C−H Acidities to the Properties of Localized Reactive Orbital». J. Org. Chem. 69: 4309–4316. 2004. PMID 15202884. doi:10.1021/jo049456f
- ↑ «Meldrum's acid in organic synthesis. 2. A general and versatile synthesis of β-keto esters». J. Org. Chem. 43: 2087–2088. 1978. doi:10.1021/jo00404a066
- ↑ «Synthetic Applications of the Pyrolysis of Meldrum's Acid Derivatives». Synthesis. 2001: 2059–2074. doi:10.1055/s-2001-18057
- ↑ «Meldrum's Acids and 5-Alkylidene Meldrum's Acids in Catalytic Carbon–Carbon Bond-Forming Processes». Acc. Chem. Res. 43: 440–454. 2009. doi:10.1021/ar900229z
- ↑ «Meldrum's acid in organic synthesis. 1. A convenient one-pot synthesis of ethyl indolepropionates». Tetrahedron Letters. 19: 1759–1762. 1978. doi:10.1016/0040-4039(78)80037-9
- ↑ «One hundred years of Meldrum's acid: Advances in the synthesis of pyridine and pyrimidine derivatives». Mol. Divers. 13: 399–419. 2009. PMID 19381852. doi:10.1007/s11030-009-9136-x
- ↑ «Meldrum's Acid». Synlett. 2004: 1649–1650. 2004. doi:10.1055/s-2004-829539