Difluoreto de dioxigénio
O difluoreto de dioxigénio é o composto químico de fórmula O2F2. É um sólido alaranjado que funde a -163 °C, formando um líquido vermelho.[1][2] O O2F2 é muito menos estável do que o principal fluoreto de oxigénio, OF2. Possui fortes propriedades oxidantes e decompõe-se em oxigénio e flúor mesmo a -160 °C (num ritmo de cerca de 4% por dia).
Estrutura Molecular[editar | editar código-fonte]
O difluoreto de dioxigénio é um composto molecular. Em O2F2 o oxigénio assume o estado de oxidação +1, enquanto que na maioria dos seus compostos, o oxigénio possui estado de oxidação -2.
A estrutura da molécula é semelhante à do peróxido de hidrogénio, H2O2, com um ângulo diedro próximo de 90°. A distância O−O é, no entanto, muito mais curta, e é muito semelhante à encontrada na ligação O=O no oxigénio gasoso (120,7 pm). Esta geometria está de acordo com a teoria VSEPR.
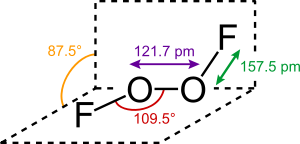
Ao longo dos anos tem havido muitas especulações para justificar uma distância O−O muito curta e a distância O−F muito longa. Em 1999, foi proposto um esquema que prevê um triplo enlace O−O com ligações simples O−F, que são desestabilizadas e alongadas por repulsão entre os dupletos (par solitário) não partilhados sobre os átomos de flúor, e os orbitais π do enlace O−O.[3]
Resumo[editar | editar código-fonte]
O difluoreto de dioxigénio pode ser obtido através da passagem de uma descarga eléctrica de 25-30 mA a 2,1−2,4 kV através de uma mistura de oxigénio e flúor gasoso a baixa pressão (7-17 mm hg). Este foi essencialmente o procedimento seguido em 1933, por Otto Ruff, que foi o primeiro a sintetizar O2F2.[1] Um outro método consiste em irradiar por algumas horas com uma bremsstrahlung de 3 MeV uma mistura de oxigénio e flúor líquido a -196 °C, num recipiente de aço inoxidável.
- O2 + F2 → O2F2
Reactividade[editar | editar código-fonte]
A propriedade principal deste composto instável é a sua forte capacidade oxidante, que se manifesta violentamente e de modo altamente explosivo, mesmo a temperaturas muito baixas, nas quais é preciso operar (abaixo de -100 °C). Por exemplo, explode em contato com a água, álcool etílico, cloro e enxofre, a temperaturas próximas do seu ponto de fusão.[4] O O2F2 converte ClF em ClF3, BrF3 em BrF5 e SF4 em SF6. Com BF3 e PF5 são também obtidos os sais de dioxigenil correspondentes:[5][6]
- 2O2F2 + 2PF5 → 2[O2]+[PF6]− + F2
Ele também pode converter os óxidos de urânio e plutónio nos correspondentes hexafluoreto.[7]
Referências[editar | editar código-fonte]
- ↑ a b O. Ruff e W. Menzel (1933). «Neue Sauerstofffluoride: O2F2 und OF». Z. anorg. allg. Chem. 211 (1-2): 204-208. doi:10.1002/zaac.19332110122
- ↑ A. D. Kirshenbaum e A. V. Grosse (1959). «Ozone fluoride or trioxygen difluoride, O3F2». J. Am. Chem. Soc. 81 (6): 1277-1279. doi:10.1021/ja01515a003
- ↑ A. J. Bridgeman e J. Rothery (1999). «Bonding in mixed halogen and hydrogen peroxides». J. Chem. Soc., Dalton Trans.: 4077-4082. doi:10.1039/A904968A
- ↑ A. G. Streng (1963). «The chemical properties of dioxygen difluoride». J. Am. Chem. Soc. 85 (10): 1380–1385. doi:10.1021/ja00893a004
- ↑ I. J. Solomon, R. I. Brabets, R. K. Uenishi, J. N. Keith, e J. M. McDonough (1964). «New dioxygenyl compounds». Inorg. Chem. 3 (3): 457. doi:10.1021/ic50013a036
- ↑ A. F. Holleman e A. F. Wiberg (2001). Inorganic Chemistry. [S.l.]: Academic Press. ISBN 0-12-352651-5
- ↑ D. A. Atwood (2006). Fluorine: Inorganic chemistry. In Encyclopedia of Inorganic Chemistry. [S.l.]: John Wiley & Sons. doi:10.1002/0470862106.ia076
Bibliografia[editar | editar código-fonte]
- Greenwood, N. N.; A. Earnshaw (1997). Chemistry of the elements 2 ed. Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4
