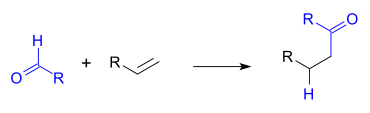
Hidroacilação
Hidroacilação é um tipo de reação orgânica no qual um aldeído é adicionado ao longo de uma cadeia de alceno ou alcino. O produto da reação é uma cetona. A reação requer um catalisador de metal e a reação intramolecular é favorecido sobre uma intermolecular. Com alcinos o produto da reação é uma cetona α,β-insaturada, incluindo a ciclopentenona.[1]
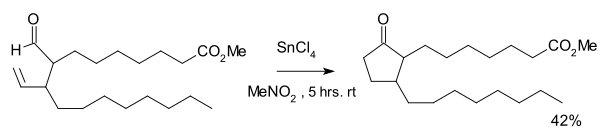
A reação foi descoberta por K. Sakai em 1972 como parte de uma via de síntese para certos prostanóides, tendo como reagente o tetracloreto de estanho.[2] Com uma quantidade estequiométrica de catalisador de Wilkinson em clorofórmio, acetonitrila ou benzeno uma quantidade igual de um ciclopropano foi formada como o resultado de descarbonilação.
A primeira aplicação catalítica foi relatada por Miller, em 1976 [3] na reação de 4-pentenal com o catalisador de Wilkinson para formar ciclopentanona. Nesta reação, o solvente foi saturado com etileno.
A formação de anel ciclopentano é favorecida, sendo o produto da reação de 5-pentenal novamente uma ciclopentanona. Outro catalisador adequado é composto de ródio catiônico Rh(dppe)CIO4 (perclorado de dppe ródio).
Mecanismo de reação[editar | editar código-fonte]
Em geral, um mecanismo de reação em um passo a hidroacilação é adição oxidativa de metal na ligação carbono-hidrogênio do aldeído seguida de adição “ao lado” do alceno, seguida pela eliminação redutiva.[1] Uma reação colateral é a descarbonilação do hidreto de metal acilo RCH2(CO)MH ao alcano RCH3 e M(CO) via o intermediário RCH2M(CO)H.
Hidroacilação assimétrica[editar | editar código-fonte]
Hidroacilação como uma reação assimétrica foi demonstrada pela primeira vez por James e Young em 1983 (resolução cinética) [4][5] e por Sakai em 1989 (verdadeira síntese assimétrica) [6][7] tanto empregando ródio como um ligando difosfina quiral. Numa aplicação o ligando é Me-DuPHOS:[8]
Referências
- ↑ a b Michael C. Willis; Transition Metal Catalyzed Alkene and Alkyne Hydroacylation; Chem. Rev. 2009 doi:10.1021/cr900096x
- ↑ Synthetic studies on prostanoids 1 synthesis of methyl 9-oxoprostanoate K. Sakai, J. Ide, O. Oda and N. Nakamura Tetrahedron Letters Volume 13, Issue 13, 1972, Pages 1287-1290 doi:10.1016/S0040-4039(01)84569-X
- ↑ Transition-Metal-Promoted Aldehyde-Alkene Addition Reactions Charles F. Lochow, Roy G. Miller J. Am. Chem. Soc., 1976, 98 (5), pp 1281–1283 doi:10.1021/ja00421a050
- ↑ The Asymmetric cyclisation of substituted pent-4-enals by a chiral rhodium phosphine catalyst Brian R. James and Charles G. Young J. Chem. Soc., Chem. Commun., 1983, 1215 - 1216, doi:10.1039/C39830001215
- ↑ Catalytic decarbonylation, hydroacylation, and resolution of racemic pent-4-enals using chiral bis(di-tertiary-phosphine) complexes of rhodium(I) Brian R. James, and Charles G. Young Journal of Organometallic Chemistry Volume 285, Issues 1-3, 16 April 1985, Pages 321-332 doi:10.1016/0022-328X(85)87377-0
- ↑ Asymmetric cyclization reactions by Rh(I) with chiral ligands Yukari Tauraa, Masakazu Tanakaa, Kazuhisa Funakoshia and Kiyoshi Sakai Tetrahedron Letters Volume 30, Issue 46, 1989, Pages 6349-6352 doi:10.1016/S0040-4039(01)93891-2
- ↑ Asymmetric cyclization reactions. Cyclization of substituted 4-pentenals into cyclopentanone derivatives by rhodium(I) with chiral ligands Yukari Taura, Masakazu Tanaka, Xiao-Ming Wu, Kazuhisa Funakoshi and Kiyoshi Sakai Tetrahedron Volume 47, Issue 27, 1991, Pages 4879-4888 doi:10.1016/S0040-4020(01)80954-6
- ↑ Synthesis of D- and L-Carbocyclic Nucleosides via Rhodium-Catalyzed Asymmetric Hydroacylation as the Key Step Patricia Marce, Yolanda Dıaz, M. Isabel Matheu, Sergio Castillon Org. Lett., 2008, 10 (21), pp 4735–4738 doi:10.1021/ol801791g