Ribonuclease P
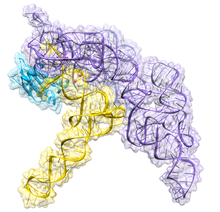
Ribonuclease P (EC 3.1.26.5, RNase P) é um tipo de ribonuclease que quebra o RNA. A RNase P é única em relação às outras RNases, pois é uma ribozima - um ácido ribonucleico que atua como catalisador da mesma maneira que uma enzima à base de proteína. Sua função é separar uma seqüência extra, ou precursora, de RNA nas moléculas de tRNA.[1] Além disso, a RNase P é uma das duas ribozimas de rotatividade múltipla conhecidas na natureza (a outra é o ribossomo), cuja descoberta rendeu a Sidney Altman e Thomas Cech o Prêmio Nobel de Química em 1989: nos anos 70, Altman descobriu a existência de precursor O RNAt com sequências de flanqueamento e foi o primeiro a caracterizar a RNase P e sua atividade no processamento da sequência líder 5 'do RNAt precursor. Resultados recentes também revelam que a RNase P tem uma nova função.[2] Foi demonstrado que a RNase P humana nuclear é necessária para a transcrição normal e eficiente de vários pequenos RNAs não codificantes, como os genes tRNA, 5S rRNA, SRP RNA e U6 snRNA,[3] que são transcritos pela RNA polimerase III, uma das três principais polimerases de RNA nuclear em células humanas.
Em bactérias[editar | editar código-fonte]
A RNase bacteriana P possui dois componentes: uma cadeia de RNA, chamada RNA M1, e uma cadeia de polipeptídeo, ou proteína, chamada proteína C5.[4][5] In vivo, ambos os componentes são necessários para que a ribozima funcione adequadamente, mas in vitro, o RNA M1 pode atuar sozinho como um catalisador.[1] O papel principal da proteína C5 é aumentar a afinidade de ligação ao substrato e a taxa catalítica da enzima M1 RNA, provavelmente aumentando a afinidade do íon metálico no local ativo. A estrutura cristalina de uma holoenzima bacteriana de RNase P com tRNA foi recentemente resolvida, mostrando como os grandes domínios helicoidais do ARN da RNase P, empilhados coaxialmente, se envolvem no reconhecimento seletivo da forma do alvo pré-tRNA. Essa estrutura cristalina confirma modelos anteriores de reconhecimento e catálise de substrato, identifica a localização do local ativo e mostra como o componente da proteína aumenta a funcionalidade da RNase P.[6][7]
RNase bacteriana P classe A e B[editar | editar código-fonte]
A ribonuclease P (RNase P) é uma endoribonuclease onipresente, encontrada em arquéias, bactérias e eucariontes, além de cloroplastos e mitocôndrias. Sua atividade mais bem caracterizada é a geração de extremidades 5'maduras de tRNAs, clivando os elementos líderes 5'de tRNAs precursores. As RNase Ps celulares são ribonucleoproteínas (RNP). O RNA da RNase Ps bacteriana retém sua atividade catalítica na ausência da subunidade proteica, ou seja, é uma ribozima. Não foi demonstrado que o RNA isolado da RNase P eucariótica e archaeal retém sua função catalítica, mas ainda é essencial para a atividade catalítica da holoenzima. Embora as holoenzimas arcaicas e eucarióticas tenham um conteúdo proteico muito maior do que as eubacterianas, os núcleos de RNA das três linhagens são homólogos - hélices correspondentes a P1, P2, P3, P4 e P10 / 11 são comuns a toda RNase P celular RNAs. No entanto, há considerável variação de sequência, particularmente entre os RNAs eucarióticos.
Na archaea[editar | editar código-fonte]
Na archaea, as ribonucleoproteínas da RNase P consistem em 4-5 subunidades proteicas associadas ao RNA. Como revelado por experimentos de reconstituição in vitro, essas subunidades de proteínas são dispensáveis individualmente para o processamento de tRNA que é essencialmente mediado pelo componente de RNA.[8][9][10] As estruturas das subunidades proteicas da RNase P archaeal foram resolvidas por cristalografia de raios-X e RMN, revelando novos domínios proteicos e dobrando fundamental para a função.
Usando genômica comparativa e métodos computacionais aprimorados, uma forma radicalmente minimizada do RNA da RNase P, apelidada de "Tipo T", foi encontrada em todos os genomas completos da família filogenética crenarchaeal Thermoproteaceae, incluindo espécies dos gêneros Pyrobaculum, Caldivirga e Vulcanisaeta.[11] Todos mantêm um domínio catalítico convencional, mas não possuem um domínio de especificidade reconhecível. A atividade de processamento de 5 'tRNA do RNA sozinha foi confirmada experimentalmente. Os RNAs de Pyrobaculum e Caldivirga RNase P são a menor forma natural ainda descoberta que funciona como ribozimas de ação trans. A perda do domínio de especificidade nesses RNAs sugere uma potencial especificidade de substrato alterada.
Recentemente, foi argumentado que o archaebacteriium Nanoarchaeum equitans não possui RNase P. Os estudos computacionais e experimentais falharam em encontrar evidências de sua existência. Nesse organismo, o promotor de tRNA está próximo ao gene de tRNA e acredita-se que a transcrição comece na primeira base do tRNA, removendo assim a necessidade de RNase P.[12]
Em eucariotos[editar | editar código-fonte]
Em eucariotos, como humanos e leveduras, a maioria das RNase P consiste em uma cadeia de RNA estruturalmente semelhante à encontrada em bactérias,[13] além de nove a dez proteínas associadas (em oposição à única proteína bacteriana da RNase P, C5).[2][14] Cinco dessas subunidades de proteínas exibem homologia com contrapartes archaeais. Essas subunidades proteicas da RNase P são compartilhadas com a RNase MRP,[15][16] uma ribonucleoproteína catalítica envolvida no processamento de RNA ribossômico no nucléolo.[17] Recentemente, a RNase P de eucariotos demonstrou ser uma ribozima.[18] Consequentemente, as numerosas subunidades proteicas da RNase P eucária têm uma pequena contribuição para o processamento do RNAt per se,[19] enquanto parecem ser essenciais para a função da RNase P e da RNase MRP em outros contextos biológicos, como a transcrição de genes e a célula. ciclo.[3][20] Apesar das origens bacterianas das mitocôndrias e cloroplastos, os plastídeos de animais e plantas superiores não parecem conter uma RNase P. baseada em RNA. Foi demonstrado que a RNase P mitocondrial humana é uma proteína e não contém RNA.[21] Também foi demonstrado que o cloroplasto de espinafre RNase P funciona sem uma subunidade de RNA.[22]
Terapias usando RNase P[editar | editar código-fonte]
A RNase P está agora sendo estudada como uma terapia potencial para doenças como o vírus herpes simplex,[23] citomegalovírus,[24] influenza e outras infecções respiratórias,[25] HIV-1[26] e câncer causado pelo gene de fusão BCR-ABL.[27] Sequências guia externas (EGSs) são formadas com complementaridade ao mRNA viral ou oncogênico e estruturas que imitam a alça T e a haste aceitadora do tRNA. Essas estruturas permitem que a RNase P reconheça o EGS e corte o mRNA alvo. As terapias com EGS demonstraram ser eficazes em cultura e em camundongos vivos.[28]
Referências
- ↑ a b «The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme». Cell. 35. PMID 6197186. doi:10.1016/0092-8674(83)90117-4
- ↑ a b «Human RNase P: a tRNA-processing enzyme and transcription factor». Nucleic Acids Res. 35. PMC 1920233
 . PMID 17483522. doi:10.1093/nar/gkm071
. PMID 17483522. doi:10.1093/nar/gkm071
- ↑ a b «A role for the catalytic ribonucleoprotein RNase P in RNA polymerase III transcription». Genes Dev. 20. PMC 1482482
 . PMID 16778078. doi:10.1101/gad.386706
. PMID 16778078. doi:10.1101/gad.386706
- ↑ «RNase P: interface of the RNA and protein worlds». Trends Biochem. Sci. 31. PMID 16679018. doi:10.1016/j.tibs.2006.04.007
- ↑ «Molecular modeling of the three-dimensional structure of the bacterial RNase P holoenzyme». J. Mol. Biol. 325. PMID 12507471. doi:10.1016/S0022-2836(02)01267-6
- ↑ «Structure of a bacterial ribonuclease P holoenzyme in complex with tRNA». Nature. 468. PMC 3058908
 . PMID 21076397. doi:10.1038/nature09516
. PMID 21076397. doi:10.1038/nature09516
- ↑ «RNase P: At last, the key finds its lock». RNA. 17. PMC 3162327
 . PMID 21803972. doi:10.1261/rna.2841511
. PMID 21803972. doi:10.1261/rna.2841511
- ↑ «Archaeal RNase P has multiple protein subunits homologous to eukaryotic nuclear RNase P proteins». RNA. 8. PMC 1370252
 . PMID 12003490. doi:10.1017/S1355838202028492
. PMID 12003490. doi:10.1017/S1355838202028492
- ↑ «A fifth protein subunit Ph1496p elevates the optimum temperature for the ribonuclease P activity from Pyrococcus horikoshii OT3». Biochem. Biophys. Res. Commun. 343. PMID 16574071. doi:10.1016/j.bbrc.2006.02.192
- ↑ «Functional reconstitution and characterization of Pyrococcus furiosus RNase P». Proc. Natl. Acad. Sci. U.S.A. 103. PMC 1637551
 . PMID 17053064. doi:10.1073/pnas.0608000103
. PMID 17053064. doi:10.1073/pnas.0608000103
- ↑ «Discovery of a minimal form of RNase P in Pyrobaculum». Proc. Natl. Acad. Sci. U.S.A. 107. PMC 3012483
 . PMID 21135215. doi:10.1073/pnas.1013969107
. PMID 21135215. doi:10.1073/pnas.1013969107
- ↑ «Life without RNase P». Nature. 453. PMID 18451863. doi:10.1038/nature06833
- ↑ «Structure and Function of Eukaryotic Ribonuclease P RNA». Mol. Cell. 24. PMC 1716732
 . PMID 17081993. doi:10.1016/j.molcel.2006.09.011
. PMID 17081993. doi:10.1016/j.molcel.2006.09.011
- ↑ «Purification and characterization of the nuclear RNase P holoenzyme complex reveals extensive subunit overlap with RNase MRP». Genes Dev. 12. PMC 316871
 . PMID 9620854. doi:10.1101/gad.12.11.1678
. PMID 9620854. doi:10.1101/gad.12.11.1678
- ↑ «Characterization and purification of Saccharomyces cerevisiae RNase MRP reveals a new unique protein component». J. Biol. Chem. 280. PMID 15637077. doi:10.1074/jbc.M409568200
- ↑ «Differential association of protein subunits with the human RNase MRP and RNase P complexes». RNA. 12. PMC 1484433
 . PMID 16723659. doi:10.1261/rna.2293906
. PMID 16723659. doi:10.1261/rna.2293906
- ↑ «A big development for a small RNA». Nature. 410. PMID 11242026. doi:10.1038/35065191
- ↑ «Eukaryotic RNase P RNA mediates cleavage in the absence of protein». Proc. Natl. Acad. Sci. U.S.A. 104. PMC 1892975
 . PMID 17284611. doi:10.1073/pnas.0607326104
. PMID 17284611. doi:10.1073/pnas.0607326104
- ↑ «An important piece of the RNase P jigsaw solved». Trends Biochem. Sci. 32. PMID 17485211. doi:10.1016/j.tibs.2007.04.005
- ↑ «RNase MRP Cleaves the CLB2 mRNA To Promote Cell Cycle Progression: Novel Method of mRNA Degradation». Mol. Cell. Biol. 24. PMC 321458
 . PMID 14729943. doi:10.1128/MCB.24.3.945-953.2004
. PMID 14729943. doi:10.1128/MCB.24.3.945-953.2004
- ↑ «RNase P without RNA: Identification and functional reconstitution of the human mitochondrial tRNA processing enzyme». Cell. 135. PMID 18984158. doi:10.1016/j.cell.2008.09.013
- ↑ «Chloroplast ribonuclease P does not utilize the ribozyme-type pre-tRNA cleavage mechanism». RNA. 6. PMC 1369935
 . PMID 10786845. doi:10.1017/S1355838200991465
. PMID 10786845. doi:10.1017/S1355838200991465
- ↑ «Developing RNase P ribozymes for gene-targeting and antiviral therapy». Cell Microbiology. 6. PMID 15104592. doi:10.1111/j.1462-5822.2004.00398.x
- ↑ «RNase P ribozymes for the studies and treatment of human cytomegalovirus infections». J Clin Virol. S2. PMID 12361758
- ↑ «Gene silencing in the therapy of influenza and other respiratory diseases: Targeting to RNase P by use of External Guide Sequences (EGS)». Biologics: Targets and Therapy. 1. PMC 2721295
 . PMID 19707312
. PMID 19707312
- ↑ «Effective inhibition of Human Immunodeficiency Virus 1 replication by engineer RNase P ribozyme». PLOS ONE. 7. PMC 3530568
 . PMID 23300569. doi:10.1371/journal.pone.0051855
. PMID 23300569. doi:10.1371/journal.pone.0051855
- ↑ «In vivo inhibition by a site-specific catalytic RNA subunit of RNase P designed against the BCR-ABL oncogenic products: a novel approach for cancer treatment». Blood. 95
- ↑ «A peptide-morpholino oligomer conjugate targeting Staphylococcus aureus gyrA mRNA improves healing in an infected mouse cutaneous wound model». Int. J. Pharm. 453. PMC 3756894
 . PMID 23727592. doi:10.1016/j.ijpharm.2013.05.041
. PMID 23727592. doi:10.1016/j.ijpharm.2013.05.041
Leitura adicional[editar | editar código-fonte]
- Palestra Nobel de Sidney Altman, Prêmio Nobel de Química 1989
- «Ribonuclease P: unity and diversity in a tRNA processing ribozyme». Annu Rev Biochem. 67. PMID 9759486. doi:10.1146/annurev.biochem.67.1.153
- «The Ribonuclease P Database». Nucleic Acids Res. 27. PMC 148169
 . PMID 9847214. doi:10.1093/nar/27.1.314
. PMID 9847214. doi:10.1093/nar/27.1.314
Ligações externas[editar | editar código-fonte]
- Banco de dados RNase P em ncsu.edu
- MeSH RNase+P
- EC 3.1.26.5
