Tungstato
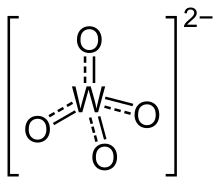
Em química, um tungstato ou volframato é um composto que contém o oxianião de tungsténio ou que é um óxido misto contendo tungsténio. O mais simples ião de tungstato é WO42−, "ortotungstato".[1] Existem muitos outros iões de tungstato que contêm mais do que um átomo de tungsténio e que pertencem a um grande grupo de iões poliatómicos chamados polioxometalatos ("POMs"), e especificamente designados isopolioxometalatos por conterem, além de oxigénio e talvez hidrogénio, apenas um outro elemento. Comparando o tungsténio com os outros elementos do grupo 6, os grandes iões tungstato geralmente contêm átomos de metal com número de coordenação 6 como no caso do molibdénio (molibdatos) e em contraste com o crómio (cromatos) em que a coordenação 4 predomina.[1]
Alguns exemplos de iões tungstato que foram detectados em solução no estado sólido incluem[2]:
- [W7O24]6− (paratungstato A)[2]
- [W10O32]4− (tungstato Y)[4]
- [H2W12O42]10− (paratungstato B) [2]
- α-[H2W12O40]6− (metatungstato)[4])
- β-[H2W12O40]6− (tungstato X)[4])
Ver categoria dos tungstatos para uma lista de tungstatos.
Ocorrência[editar | editar código-fonte]
Os tungstatos ocorrem naturalmente com os molibdatos. A powellite é uma forma mineral de molibdato de cálcio que contém uma quantidade de tungstato, e a scheelite é uma forma mineral de tungstato de cálcio que contém uma pequena quantidade de molibdato. A volframite é um tungstato de manganês e ferro, e todos eles são fontes valiosas de tungsténio.
Propriedades químicas e físicas[editar | editar código-fonte]
As soluções dos tungstatos, como as dos molibdatos, produzem soluções intensamente azuis de complexo tungstato (V,VI) análogas aos azuis de molibdénio quando reduzidos pela maioria dos materiais orgânicos.[1]
Os tungstatos podem também ser usados como agentes oxidantes na oxidação do cicloexeno. O tungstato pode ser constantemente regenerado pela presença do peróxido de hidrogénio.
Ao contrário do cromato, o tungstato não é um bom oxidante, mas tal como o cromato, polimeriza em ácidos e despolimeriza em soluções alcalinas.
Referências
- ↑ a b c Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0123526515
- ↑ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements 2nd ed. Oxford: Butterworth-Heinemann. ISBN 0080379419
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ a b c Jon A. McCleverty, N. G. Connelly,Nomenclature of inorganic chemistry II: recommendations 2000, International Union of Pure and Applied Chemistry Commission on the Nomenclature of Inorganic Chemistry, Published by Royal Society of Chemistry, 2001, ISBN 0854044876
