Usuário(a):Fernandahansen/Girificação

A girificação é o processo da formação das dobras características do córtex cerebral. O pico de cada dobra é chamado de giro, e o vale é conhecido como sulco.
Girificação durante o desenvolvimento do cérebro humano[editar | editar código-fonte]
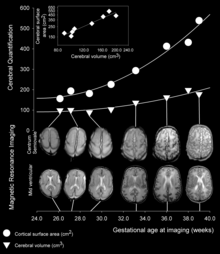
Como o desenvolvimento fetal continua, giros e sulcos começam a tomar forma, com o surgimento de aprofundar os avanços na superfície do córtex. Nem todos os giros começam a se desenvolver ao mesmo tempo. Em vez disso, o principal cortical giros primeiro o formulário (início tão precoce de gestação semana a 10 em humanos), seguido pelo secundário e terciário giros mais tarde, em desenvolvimento.[1] Um dos primeiros e mais proeminente sulcos é o sulco lateral (também conhecida como a fissura lateral ou fissura de Sylvian), seguido por outros, tal como o sulco central, que separa o córtex motor (giro precentral) do córtex somatossensorial (postcentral giro).[2] a Maioria cortical giros e sulcos começam a tomar forma entre as semanas 24 e 38 da gestação, e continuar a ampliar e maduro após o nascimento.
Vantagens evolutivas[editar | editar código-fonte]
Uma vantagem de girificação é pensado para ser o aumento da velocidade de células do cérebro de comunicação, desde cortical dobras permitir que as células sejam próximos uns dos outros, exigindo menos tempo e energia para transmitir neuronal impulsos elétricos, denominados potenciais de ação.Erro de citação: Elemento de abertura <ref> está mal formado ou tem um nome inválido Há evidências que sugerem uma relação positiva entre girificação e cognitivas de processamento de informação de velocidade, bem como melhorar a memória de trabalho verbal.Erro de citação: Elemento de abertura <ref> está mal formado ou tem um nome inválido Além disso, porque um grande crânio requer uma maior pelve durante o parto, com expressa a dificuldade na época, um pequeno crânio é mais facilmente entregue.Erro de citação: Elemento de abertura <ref> está mal formado ou tem um nome inválidoErro de citação: Elemento de abertura <ref> está mal formado ou tem um nome inválido
Teorias sobre a causalidade na girificação[editar | editar código-fonte]
Mecânico de flambagem[editar | editar código-fonte]
Os mecanismos de cortical girificação não são bem compreendidos, e várias hipóteses são debatidas na literatura científica. Um popular hipótese de que datam do tempo de Retzius no final do século 19, afirma que o mecânico de flambagem forças, devido à expansão do tecido cerebral, causa a superfície cortical para desistir.[3] Muitas teorias já foram frouxamente ligada a esta hipótese.
Um crescimento externo restrição do crânio não é pensado para causar girificação. Isto é principalmente porque o primórdio do crânio durante o período fetal, o desenvolvimento do cérebro ainda não está ossificada (endurecido no osso através de calcificação). O tecido que cobre o embrionária córtex cerebral é várias camadas finas de ectoderm (futuro pele) e mesenchyme (futuro muscular e do tecido conjuntivo, incluindo o futuro crânio). Estas camadas finas de crescer facilmente, junto com a expansão cortical, mas, eventualmente, o craniana mesenchyme diferencia-se em cartilagem; ossificação do crânio placas não ocorrer até mais tarde no desenvolvimento. O crânio humano continua a crescer substancialmente, juntamente com o cérebro após o nascimento até os pratos cranianos, finalmente fusível depois de vários anos. Estudos experimentais em animais têm ainda mostrado que cortical de dobramento pode ocorrer sem as restrições externas.[4] Craniana crescimento é, assim, concebida para ser impulsionado pelo crescimento do cérebro; mecânica e fatores genéticos intrínsecos para o cérebro são agora pensado para ser o principal drivers de gyrification. O único observado papel que o crânio pode jogar em gyrification é no achatamento dos giros como o cérebro amadurece depois cranianos, placas de fusível.
Tensão axonal[editar | editar código-fonte]
Uma teoria alternativa sugere que axonal forças de tensão entre altamente interligado áreas corticais puxar local áreas corticais para com o outro, induzindo dobras.[5] Há alguma evidência para apoiar esta hipótese. Por exemplo, os axônios em áreas do cérebro com alta gyrification níveis são retos, curtos no comprimento e encontrada para se conectar gyral paredes. Esta evidência, no entanto, não pode ser determinado a ser uma causa ou o resultado da cortical de dobramento. Enquanto curto conexões pode ser um resultado de axônios puxando as paredes formam giros, os axônios podem adaptativamente permanecem curto, devido à mecânica padrões de crescimento. Além disso, um estudo mostrou que gyrification pode ser induzida experimentalmente em o embrião de rato, mas, em estágios iniciais, na ausência de conexões axonais.[6]
Expansão diferencial tangencial[editar | editar código-fonte]
Mais recentemente, a teoria do diferencial tangencial expansão tem sido proposta, afirmando que os padrões de dobramento do cérebro são um resultado de diferentes tangencial taxas de expansão entre diferentes áreas corticais.[7] Esta é proposto para ser devido ao areal diferenças na progenitoras divisão taxas.
Fatores mecânicos[editar | editar código-fonte]
Espessura Cortical[editar | editar código-fonte]
Início condições do cérebro têm uma forte influência no seu nível final de girificação. Em particular, há uma relação inversa entre a espessura cortical e girificação. Áreas do cérebro com baixos valores de espessura são encontrados altos níveis de girificação. O inverso também é verdade, que as áreas do cérebro com altos valores de espessura são encontrados para ter níveis mais baixos de girificação.
Velocidade de crescimento[editar | editar código-fonte]
Há alguma controvérsia sobre as taxas de crescimento através do qual cortical e subcortical camadas do cérebro se desenvolver. Puramente isotrópico crescimento sugere que o cinza (casca externa) e a matéria branca (núcleo) camadas de cada crescer em separado taxas, que são uniformes em todas as dimensões. Tangencial de crescimento sugere que a matéria cinzenta cresce em um ritmo mais rápido do que o interior da substância branca, e que a taxa de crescimento da massa cinzenta determina a taxa de crescimento da matéria branca. Apesar de ambos os métodos são diferenciais, com o córtex crescendo mais rapidamente do que o subcortex, tangencial crescimento tem sido sugerida como mais plausível modelo.
Vincos na superfície do cérebro são formados como resultado da instabilidade, e tangenciais modelos de crescimento de atingir níveis de instabilidade que provocam rugas mais freqüência do que os modelos isotrópico. Este nível é chamado de um ponto crítico, no qual, os modelos preferem liberação de energia potencial por desestabilizar e formação de vincos para se tornar mais estável.
Fatores genéticos[editar | editar código-fonte]
O padrão de cortical giros e sulcos não é aleatória; a maioria das circunvoluções são conservados entre os indivíduos e também são encontrados em todas as espécies. Esta reprodutibilidade pode sugerir que os mecanismos genéticos pode especificar o local de maior giro. Os estudos de gémeos monozigóticos e dizigóticos gêmeos do final da década de 1990 apoiar esta ideia,[8] , particularmente com relação ao primário giros e sulcos, considerando que não há mais variabilidade entre o secundário e o terciário giros.[9] Portanto, pode-se levantar a hipótese de que o secundário e o terciário dobras poderia ser mais sensíveis a fatores genéticos e ambientais.[10] O primeiro gene relatada a influência gyrification foi Trnp1.[11] Local nos níveis de expressão de Trnp1, pode determinar a posição futura de um desenvolvimento de dobras/gyruy em cérebros humanos.[12][13] os Genes que influenciam a cortical progenitoras dynamics, a neurogênese e migração neuronal, assim como os genes que influenciam o desenvolvimento de circuitos corticais e projeções axonais que podem contribuir para gyrification. Trnp1 é um DNA-binding factor que tem sido mostrado para regulamentar outros genes que regulam a proliferação da cortical células progenitoras - servindo assim como um mestre gene regulador. além disso, o fator de crescimento de fibroblastos (FGF) e sonic hedgehog (SHH)-vias de sinalização recentemente tem sido relatado para ser capaz de induzir cortical dobras, com um conjunto completo de camadas corticais, em ratos, que vivem até a idade adulta.[14] Estes FGF e Shh fatores regular cortical proliferação de células-tronco e a neurogênese dynamics. Funções beta-catenin (parte da via Wnt) e níveis adequados de morte celular da cortical progenitores também foram encontrados.[15][16]
Célula de fatores biológicos[editar | editar código-fonte]
Cortical células-tronco, conhecida como radial células gliais (RGC)s, residir na zona ventricular e gerar o excitatória glutamatérgica neurônios do córtex cerebral.[17][18] Essas células proliferam rapidamente, através de auto-renovação nas primeiras fases de desenvolvimento, expandindo o progenitor piscina e aumentar a área de superfície cortical. Nesta fase, o padrão de áreas corticais é geneticamente programado por um sistema de sinalização, os centros através do processo de cortical padronização, e o primordial mapa da cortical áreas funcionais nesta fase é chamado de um 'protomap'.[19] Cortical neurogênese começa a esgotar o pool de células progenitoras, sujeito às influências de muitos genética dicas, tais como fatores de crescimento de fibroblastos (FGF)s e Entalhe.[20] RGCs gerar intermediário neuronal precursores que dividir ainda mais na zona subventricular (SVZ), ampliando o número de neurônios corticais que está sendo produzido.[21] As fibras longas de RGCs projeto através de todo o caminho do desenvolvimento do córtex para o pial superfície do cérebro, e essas fibras servem como física guias para a migração neuronal.[22] Uma segunda classe de RGC, chamado de basal RGCs (bRGC)s, forma um terceiro progenitoras piscina exterior SVZ.[23] Basal RGCs, geralmente, são muito mais abundantes na maior mamíferos. Clássico RGCs e o recentemente descrito bRGCs representam orientadores pistas que levam recém-nascido neurônios para seu destino no córtex. O aumento do número de bRGCs aumentar a densidade de orientar as fibras em um caso contrário, espalhando-se matriz que iria perder a fibra de densidade.[24] A literatura científica aponta para diferenças na dinâmica de proliferação e diferenciação neuronal em cada um desses progenitoras zonas entre espécies de mamíferos, e tais diferenças podem acarretar grandes diferenças na cortical tamanho e gyrification entre mamíferos. Uma hipótese sugere que certas células progenitoras gerar abundante neurônios destinado para o exterior camadas corticais, fazendo com que a área de superfície maior aumento nas camadas exteriores comparado com o interior camadas corticais. não fica claro como isso pode funcionar sem mais mecanicista elementos.[25][26]
Variação entre espécies[editar | editar código-fonte]
Um 'índice de girificação' (GI) tem sido utilizado como uma medida da magnitude da circunvoluções corticais na superfície do cérebro de mamíferos.[27][28] de Répteis e de aves cérebros não mostrar cortical . Mamíferos com alto GI são geralmente maiores do que aqueles com um baixo GI, por exemplo, a baleia-piloto e golfinhos roazes apresentam os mais altos valores de GI. O cérebro humano, embora maior do que a de um cavalo, mostra um semelhante GI. Roedores mostram, em geral, o menor GIs. No entanto, alguns roedores mostrar girencefalia e algumas espécies de primatas são bastante lisencéfalos.[29]
Uma relação linear entre mamíferos expressa em giroencefalia termos foi encontrado por Mota & Herculano-Houzel, 2015[30]. Eles sugerem um modelo que combina medidas morfométricas (Espessura Cortical, a Área Exposta, e Área Total) é iria me descrever gyrification.
Distúrbios neurológicos de girificação[editar | editar código-fonte]
Lisencefalia[editar | editar código-fonte]
Um córtex cerebral falta superfície circunvoluções é dito ser lisencefálico.[31] Durante o desenvolvimento embrionário, todos os mamíferos cérebros começam como lissencephalic estruturas derivadas do tubo neural. Alguns, como os cérebros dos ratinhos, permanecem lissencephalic durante a vida adulta. Tem sido demonstrado que lissencephalic espécies possuem muitos dos molecular dicas necessárias para atingir gyrencephaly, mas uma grande variedade de genes estão envolvidos na regulação do progenitoras neurais proliferação e neurogenic processos que subjazem gyrification. É a hipótese de que a spatiotemporal diferenças entre estas molecular vias, incluindo FGF, Shh, e Trnp1 e provavelmente muitos outros, determinam o tempo e a medida de gyrification em várias espécies.[32]
Lisencefalia é um estado de doença. Para os seres humanos com Lisencefalia, uma grande parte dos neurônios de não atingir o exterior córtex durante a migração neuronal, e permanecem sob a placa cortical.[33] Este deslocamento resulta não só os defeitos corticais conexões, mas também um espessamento do córtex, consistente com a idéia de que um cérebro com córtex mais grosso terá um menor grau de gyrification.[34]
Polimicrogiria[editar | editar código-fonte]
Polimicrogiria é uma condição na qual o cérebro tem uma ação demasiado complicada córtex. Embora na superfície, o cérebro parece suave com alguns sulcos, olhando para o interior do cérebro, revela uma complicada estrutura com um grande número de secundário e terciário dobras. imagens do Cérebro com ressonância magnética revela um cérebro com polymicrogyria ter uma fina córtex, consistente com a idéia de que um cérebro com uma fina córtex terá um alto nível de girificação.
Autismo[editar | editar código-fonte]
Pacientes com autismo têm níveis mais elevados de cortical gyrification,[35] , mas somente no temporal, parietal e occipital lobos, bem como parte do córtex cingulado.[36] A níveis mais elevados de gyrification são encontradas para se relacionar com maior conectividade local em cérebros autistas, sugerindo hiperconectividade.
Trnp1, que foi capaz de induzir gyrification em modelos animais também foi identificado em pacientes com transtornos do espectro do autismo doenças, indicando molecular papel de Trnp1 no autismo.[37]
As dobras do autista de cérebros humanos são encontrados a experiência ligeiros desvios no local, logo no início do desenvolvimento do cérebro. Especificamente, diferentes padrões de aparecer no frontal superior do sulco, fissura de Sylvian, o giro frontal inferior, giro temporal superior e olfativo sulcos.[38] Essas áreas se relacionam com a memória de trabalho, processamento emocional, a linguagem, e o olhar,[39] e a sua diferença em termos de localização e nível de gyrification quando comparado a um ser humano saudável do cérebro poderia explicar alguns comportamentos alterados em pacientes autistas.
Esquizofrenia[editar | editar código-fonte]
Mais condição prevalente, esquizofrenia, tem sido associado com anormalidades estruturais no cérebro. Como cérebros autistas, esquizofrênicos cérebros mostrar reduzida espessura cortical e aumento girificação quando comparados a indivíduos saudáveis do cérebro.[40]
Malformações pelo Zika vírus[editar | editar código-fonte]
Cortical malformações induzidas pela Zika vírus são devido a uma infecção durante a gravidez, e são geralmente classificados como microcefalia, ou "pequeno cérebro". Devido à grande redução no volume do córtex cerebral, em microcefalia, alterações no girificação não são inesperados. No entanto, estudos recentes do mecanismo de Zika malformações indicam que o principal defeito é devido à infecção de RGCs e subseqüente morte da célula.[41][42] a Morte de cortical de células-tronco faz com que a perda de todas as esperado células-filhas, e o escopo da malformação, portanto, depende do momento da infecção, bem como a sua gravidade durante a programação neural stem a proliferação celular e a neurogênese. Anterior infecções que normalmente seria esperado para produzir mais grave malformação.[43][44] A microcefalia e gyrification malformações são permanentes e não são conhecidos tratamentos.
Medidas da Girificação[editar | editar código-fonte]
A girificação cortical pode ser medida em termos do Índice de Girificação (GI)[45], Fractal Dimensionalidade[46] e uma combinação de morfométricas termos (Área, Espessura, Volume)[47]. A GI é definido como a razão entre a Área Total e a Área Exposta ("perímetro do cérebro delineada em duas dimensões coronal seções"[48]). FreeSurfer, uma reconstrução de superfície do software é uma das ferramentas disponíveis para medir o GI[49].
Imagens adicionais[editar | editar código-fonte]
-
Vários cérebros. No sentido horário, do topo à esquerda: Adulto rhesus; rato Adulto; segundo trimestre da gestação humana; Recém-nascido humano; humano Adulto.
-
Normal humanos adultos cérebro (esquerdo), polymicrogyria (centro) e lissencephaly (direita).
Veja também[editar | editar código-fonte]
- Ulegyria
Referências[editar | editar código-fonte]
- ↑ Rajagopalan, V; Scott, J; Habas, PA; Kim, K; Corbett-Detig, J; Rousseau, F; Barkovich, AJ; Glenn, OA; Studholme, C (23 February 2011). «Local tissue growth patterns underlying normal fetal human brain gyrification quantified in utero.». The Journal of Neuroscience. 31 (8): 2878–87. PMC 3093305
 . PMID 21414909. doi:10.1523/jneurosci.5458-10.2011 Verifique data em:
. PMID 21414909. doi:10.1523/jneurosci.5458-10.2011 Verifique data em: |data=(ajuda) - ↑ Bayer, Shirley A; Altman, Joseph (2005). The Human Brain during the Second Trimester. [S.l.: s.n.] ISBN 978-0-8493-1422-3
- ↑ Ronan, L; Voets, N; Rua, C; Alexander-Bloch, A; Hough, M; Mackay, C; Crow, TJ; James, A; Giedd, JN; Fletcher, PC (August 2014). «Differential tangential expansion as a mechanism for cortical gyrification.». Cerebral Cortex. 24 (8): 2219–28. PMC 4089386
 . PMID 23542881. doi:10.1093/cercor/bht082 Verifique data em:
. PMID 23542881. doi:10.1093/cercor/bht082 Verifique data em: |data=(ajuda) - ↑ Tallinen, Tuomas; Chung, Jun Young; Biggins, John S.; Mahadevan, L. (2 de setembro de 2014). «Gyrification from constrained cortical expansion». Proceedings of the National Academy of Sciences (em inglês). 111 (35): 12667–12672. Bibcode:2014PNAS..11112667T. ISSN 0027-8424. PMC 4156754
 . PMID 25136099. arXiv:1503.03853
. PMID 25136099. arXiv:1503.03853 . doi:10.1073/pnas.1406015111
. doi:10.1073/pnas.1406015111
- ↑ Van Essen, DC (23 January 1997). «A tension-based theory of morphogenesis and compact wiring in the central nervous system». Nature. 385 (6614): 313–8. Bibcode:1997Natur.385..313E. PMID 9002514. doi:10.1038/385313a0 Verifique data em:
|data=(ajuda) - ↑ «Cortical gyrification induced by fibroblast growth factor 2 in the mouse brain.». The Journal of Neuroscience. 33. PMC 3693057
 . PMID 23804101. doi:10.1523/jneurosci.3621-12.2013
. PMID 23804101. doi:10.1523/jneurosci.3621-12.2013
- ↑ «Differential tangential expansion as a mechanism for cortical gyrification.». Cerebral Cortex. 24. PMC 4089386
 . PMID 23542881. doi:10.1093/cercor/bht082
. PMID 23542881. doi:10.1093/cercor/bht082
- ↑ Bartley, AJ; Jones, DW; Weinberger, DR (February 1997). «Genetic variability of human brain size and cortical gyral patterns.». Brain. 120 (2): 257–69. PMID 9117373. doi:10.1093/brain/120.2.257 Verifique data em:
|data=(ajuda) - ↑ «The development of gyrification in childhood and adolescence». Brain and Cognition. Adolescent Brain Development: Current Themes and Future Directions. 72. PMC 2815169
 . PMID 19942335. doi:10.1016/j.bandc.2009.10.009
. PMID 19942335. doi:10.1016/j.bandc.2009.10.009
- ↑ «Increased morphological asymmetry, evolvability and plasticity in human brain evolution». Proc. R. Soc. B. 280. ISSN 0962-8452. PMC 3652445
 . PMID 23615289. doi:10.1098/rspb.2013.0575
. PMID 23615289. doi:10.1098/rspb.2013.0575
- ↑ Stahl, Ronny; Walcher, Tessa; De Juan Romero, Camino; Pilz, Gregor Alexander; Cappello, Silvia; Irmler, Martin; Sanz-Aquela, José Miguel; Beckers, Johannes; Blum, Robert (25 de abril de 2013). «Trnp1 regulates expansion and folding of the mammalian cerebral cortex by control of radial glial fate». Cell. 153 (3): 535–549. ISSN 1097-4172. PMID 23622239. doi:10.1016/j.cell.2013.03.027
- ↑ «Discrete domains of gene expression in germinal layers distinguish the development of gyrencephaly». The EMBO Journal. 34. ISSN 1460-2075. PMC 4547892
 . PMID 25916825. doi:10.15252/embj.201591176
. PMID 25916825. doi:10.15252/embj.201591176
- ↑ «Cerebral cortex expansion and folding: what have we learned?». The EMBO Journal. 35. ISSN 1460-2075. PMC 4868950
 . PMID 27056680. doi:10.15252/embj.201593701
. PMID 27056680. doi:10.15252/embj.201593701
- ↑ «Hedgehog signaling promotes basal progenitor expansion and the growth and folding of the neocortex». Nature Neuroscience. 19. PMC 4925239
 . PMID 27214567. doi:10.1038/nn.4307
. PMID 27214567. doi:10.1038/nn.4307
- ↑ «Regulation of cerebral cortical size by control of cell cycle exit in neural precursors». Science. 297. Bibcode:2002Sci...297..365C. PMID 12130776. doi:10.1126/science.1074192
- ↑ «Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9.». Cell. 94. PMID 9708735. doi:10.1016/s0092-8674(00)81476-2
- ↑ Noctor, SC; Flint, AC; Weissman, TA; Dammerman, RS; Kriegstein, AR (8 February 2001). «Neurons derived from radial glial cells establish radial units in neocortex.». Nature. 409 (6821): 714–20. PMID 11217860. doi:10.1038/35055553 Verifique data em:
|data=(ajuda) - ↑ Malatesta, P; Hartfuss, E; Götz, M (December 2000). «Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage.». Development. 127 (24): 5253–63. PMID 11076748 Verifique data em:
|data=(ajuda) - ↑ «Specification of cerebral cortical areas». Science. 241. Bibcode:1988Sci...241..170R. PMID 3291116. doi:10.1126/science.3291116
- ↑ «FGF signaling expands embryonic cortical surface area by regulating Notch-dependent neurogenesis.». The Journal of Neuroscience. 31. PMC 3235689
 . PMID 22031906. doi:10.1523/jneurosci.4439-11.2011
. PMID 22031906. doi:10.1523/jneurosci.4439-11.2011
- ↑ Noctor, SC; Martínez-Cerdeño, V; Ivic, L; Kriegstein, AR (February 2004). «Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases.». Nature Neuroscience. 7 (2): 136–44. PMID 14703572. doi:10.1038/nn1172 Verifique data em:
|data=(ajuda) - ↑ «Mode of cell migration to the superficial layers of fetal monkey neocortex.». The Journal of Comparative Neurology. 145. PMID 4624784. doi:10.1002/cne.901450105
- ↑ LaMonica, BE; Lui, JH; Wang, X; Kriegstein, AR (October 2012). «OSVZ progenitors in the human cortex: an updated perspective on neurodevelopmental disease.». Current Opinion in Neurobiology. 22 (5): 747–53. PMC 3402619
 . PMID 22487088. doi:10.1016/j.conb.2012.03.006 Verifique data em:
. PMID 22487088. doi:10.1016/j.conb.2012.03.006 Verifique data em: |data=(ajuda) - ↑ Hansen, DV; Lui, JH; Parker, PR; Kriegstein, AR (25 March 2010). «Neurogenic radial glia in the outer subventricular zone of human neocortex». Nature. 464 (7288): 554–561. Bibcode:2010Natur.464..554H. PMID 20154730. doi:10.1038/nature08845 Verifique data em:
|data=(ajuda) - ↑ «The (not necessarily) convoluted role of basal radial glia in cortical neurogenesis.». Cerebral Cortex. 22. PMC 3256413
 . PMID 22116731. doi:10.1093/cercor/bhr336
. PMID 22116731. doi:10.1093/cercor/bhr336
- ↑ «Compartmentalization of cerebral cortical germinal zones in a lissencephalic primate and gyrencephalic rodent.». Cerebral Cortex. 22. PMID 22114081. doi:10.1093/cercor/bhr312
- ↑ «Cortical folding: when, where, how, and why?». Annual Review of Neuroscience. 38. PMID 25897870. doi:10.1146/annurev-neuro-071714-034128
- ↑ «Gyrification in the cerebral cortex of primates.». Brain, Behavior and Evolution. 34. PMID 2512000. doi:10.1159/000116500
- ↑ «The (not necessarily) convoluted role of basal radial glia in cortical neurogenesis.». Cerebral Cortex. 22. PMC 3256413
 . PMID 22116731. doi:10.1093/cercor/bhr336
. PMID 22116731. doi:10.1093/cercor/bhr336
- ↑ «Cortical folding scales universally with surface area and thickness, not number of neurons». Science. 349. ISSN 0036-8075. PMID 26138976. doi:10.1126/science.aaa9101
- ↑ «The ontogeny of human gyrification.». Cerebral Cortex. 5. PMID 7719130. doi:10.1093/cercor/5.1.56
- ↑ Wang, Lei; Hou, Shirui; Han, Young-Goo (23 de maio de 2016). «Hedgehog signaling promotes basal progenitor expansion and the growth and folding of the neocortex». Nature Neuroscience. 19 (7): 888–96. ISSN 1546-1726. PMC 4925239
 . PMID 27214567. doi:10.1038/nn.4307
. PMID 27214567. doi:10.1038/nn.4307
- ↑ Budday, Silvia; Raybaud, Charles; Kuhl, Ellen (10 de julho de 2014). «A mechanical model predicts morphological abnormalities in the developing human brain». Scientific Reports (em inglês). 4. 5644 páginas. Bibcode:2014NatSR...4E5644B. PMC 4090617
 . PMID 25008163. doi:10.1038/srep05644
. PMID 25008163. doi:10.1038/srep05644
- ↑ Ross, M. Elizabeth; Walsh, Christopher A. (1 de janeiro de 2001). «Human Brain Malformations and Their Lessons for Neuronal Migration». Annual Review of Neuroscience. 24 (1): 1041–1070. PMID 11520927. doi:10.1146/annurev.neuro.24.1.1041
- ↑ «Increased gyrification, but comparable surface area in adolescents with autism spectrum disorders». Brain. 136. ISSN 0006-8950. PMC 3673467
 . PMID 23715094. doi:10.1093/brain/awt106
. PMID 23715094. doi:10.1093/brain/awt106
- ↑ «Cortical morphological markers in children with autism: a structural magnetic resonance imaging study of thickness, area, volume, and gyrification». Molecular Autism. 7. PMC 4727390
 . PMID 26816612. doi:10.1186/s13229-016-0076-x
. PMID 26816612. doi:10.1186/s13229-016-0076-x
- ↑ Stahl, Ronny. Identification and functional analysis of Trnp1: a novel DNA associated protein with a key role in neurogenesis. [S.l.: s.n.]
- ↑ «The Emerging Picture of Autism Spectrum Disorder: Genetics and Pathology». Annual Review of Pathology: Mechanisms of Disease. 10. PMID 25621659. doi:10.1146/annurev-pathol-012414-040405
- ↑ «Cortical Sulcal Maps in Autism». Cerebral Cortex. 13. ISSN 1047-3211. PMID 12816888. doi:10.1093/cercor/13.7.728
- ↑ «Folding of the Prefrontal Cortex in Schizophrenia: Regional Differences in Gyrification». Biological Psychiatry. 69. PMID 21257157. doi:10.1016/j.biopsych.2010.12.012
- ↑ «Expression Analysis Highlights AXL as a Candidate Zika Virus Entry Receptor in Neural Stem Cells.». Cell Stem Cell. 18. PMID 27038591. doi:10.1016/j.stem.2016.03.012
- ↑ «Zika Virus Disrupts Neural Progenitor Development and Leads to Microcephaly in Mice». Cell Stem Cell. 19. PMID 27179424. doi:10.1016/j.stem.2016.04.017
- ↑ «Vertical transmission of Zika virus targeting the radial glial cells affects cortex development of offspring mice». Cell Research. 26. ISSN 1748-7838. PMC 4897185
 . doi:10.1038/cr.2016.58
. doi:10.1038/cr.2016.58
- ↑ «Zika Virus Infects Human Cortical Neural Progenitors and Attenuates Their Growth». Cell Stem Cell. 18. ISSN 1934-5909. PMID 26952870. doi:10.1016/j.stem.2016.02.016
- ↑ «The human pattern of gyrification in the cerebral cortex». Anatomy and Embryology. 179. ISSN 0340-2061. doi:10.1007/BF00304699
- ↑ «Cortical complexity as a measure of age-related brain atrophy». NeuroImage. 134. ISSN 1053-8119. doi:10.1016/j.neuroimage.2016.04.029
- ↑ «Cortical folding scales universally with surface area and thickness, not number of neurons». Science. 349. ISSN 0036-8075. PMID 26138976. doi:10.1126/science.aaa9101
- ↑ «LGI - Free Surfer Wiki». surfer.nmr.mgh.harvard.edu
- ↑ «A Surface-Based Approach to Quantify Local Cortical Gyrification». IEEE Transactions on Medical Imaging. 27. ISSN 0278-0062. doi:10.1109/tmi.2007.903576
[[Categoria:Giros]]

