Usuário:JMagalhães/Notepad51
História da teoria atómica[editar | editar código-fonte]
O termo átomo tem origem no grego ἄτομος (atomos, "indivisível"), formado a partir de ἀ- (a-, "não") e τέμνω (temnō, "cortar"),[1] o que significa qualquer coisa que não pode ser cortada ou é indivisível.[2] O conceito de átomo enquanto componente indivisível da matéria foi inicialmente proposto por filósofos gregos e indianos. Nos séculos XVIII e XIX, foi estabelecida a explicação física para esta ideia ao demonstrar que havia um limite para a divisão de determinadas substâncias através de métodos químicos, tendo feito um paralelismo entre essa entidade química e o conceito filosófico da antiguidade. Durante o final do século XIX e início do século XX, foram descobertos componentes subatómicos e estruturas no interior do átomo, demonstrando assim que o "átomo químico" podia ser dividido e o termo poderia não ser o mais apropriado.[3][4]
Antiguidade[editar | editar código-fonte]
O conceito de que a matéria é constituída por unidades individuais e que não pode ser dividida em quantidades cada vez mais pequenas de forma arbitrária existe há vários milénios. No entanto, este conceito tinha por base noções filosóficas, e não o experimentalismo ou a observação empírica. A natureza dos átomos em filosofia variou consideravelmente ao longo do tempo e entre culturas e escolas de pensamento, tendo muitas vezes associados elementos espirituais. As primeiras referências ao conceito de átomo datam da antiguidade indiana no século VI a.C.[5] As escolas Nyaya e Vaisheshika desenvolveram teorias complexas sobre como os átomos se combinavam entre si para formar objetos mais complexos, primeiro em pares e depois em trios de pares.[6][7] No Ocidente, as primeiras referências aos átomos surgem um século mais tarde com Leucipo, cujo pensamento foi sistematizado pelo seu aluno Demócrito. Por volta de 450 a.C., Demócrito cunhou o termo átomos (grego: ἄτομος), que significa "indivisível" ou a "mais pequena partícula indivisível da matéria"; isto é, qualquer coisa que não pode ser dividida. Embora nos conceitos indiano e grego os átomos se baseassem exclusivamente na filosofia, a ciência moderna adotou o mesmo nome proposto por Demócrito.[8]
Primeiras teorias científicas[editar | editar código-fonte]

Até ao desenvolvimento da química pouco ou nenhum progresso ocorreu no conceito de átomo. No entanto, o conceito básico de átomo explicava de forma precisa as novas descobertas que estavam a acontecer no campo da química.[8] Em 1661, o filósofo naturalista Robert Boyle publicou The Sceptical Chymist, em que argumentava que a matéria era constituída por várias combinações de "corpúsculos" ou átomos, em vez dos elementos clássicos da terra, ar, fogo e água.[9] A obra também forneceu a primeira definição de "elemento químico": um corpo simples e não misturado que não pode ser feito de outro corpo. Embora esta definição tenha sido negligenciada ao longo do século seguinte, o trabalho de Boyle é hoje considerado um marco da história da química por separar a alquimia da química.[10] É uma definição semelhante de elemento químico que consta no Traité Élémentaire de Chimie, escrito em 1789 pelo nobre e investigador científico francês Antoine Lavoisier, e que viria a dominar a química no século seguinte e que ainda hoje é influente.[11]
Ao longo do século XVIII, foram descobertos diversos elementos químicos, tais como a platina (1735),[12] o níquel (1751),[13] o magnésio (1755)[14] e o oxigénio (1771).[15][16] Porém, ainda não havia sido formulada uma teoria que explicasse uma relação inequívoca entre os átomos e os elementos químicos. Com a sistematização da Lei das proporções definidas por Joseph Louis Proust e a lei da conservação da massa por Antoine Lavoisier, foi consolidado o conhecimento que permitiu ao inglês John Dalton explicar em 1803, a partir do conceito de átomo, o motivo pelo qual os elementos reagem sempre numa pequena razão de números inteiros e o porquê de certos gases se dissolverem melhor na água do que outros. Dalton propôs que cada elemento fosse constituído por átomos de um único tipo e que grupos de átomos diferentes formariam os compostos químicos. Isto possibilitou o cálculo da massa atômica relativa dos átomos e a identificação de uma relação inequívoca entre um dado átomo e o respectivo elemento químico.[17][18] Por esse feito, Dalton é considerado o iniciador da teoria atómica moderna.[19]
Em 1817 Johann Wolfgang Döbereiner observou que os elementos podiam ser agrupados em grupos de três com propriedades semelhantes, ideia também desenvolvida por Leopold Gmelin que identificou grupos de quatro ou cinco elementos com propriedades semelhantes.[20] A organização dos elementos conforme as suas propriedades continuou a ser desenvolvida por outros cientistas como Alexandre-Emile Béguyer de Chancourtois, Julius Lothar Meyer e John Newlands, culminando com a publicação da tabela periódica de Dmitri Mendeleev em 1871. A tabela proposta por Mendeleev diferenciava-se das anteriores ao antever as propriedades de elementos que ainda não tinham sido isolados, mantendo espaços vazios na sua estrutura para serem preenchidos à medida que os elementos fossem descobertos.[21]
A teoria das partículas (e, por conseguinte, a teoria atómica) foi validada em 1827, quando o botânico Robert Brown observou ao microscópio partículas de pó a flutuar na água e descobriu que se moviam aleatoriamente – um fenómeno que veio a ficar conhecido como movimento browniano. Em 1877, J. Desaulx sugeriu que este fenómeno era causado pelo movimento térmico das moléculas de água. Em 1905, Albert Einstein publicou a primeira descrição matemática desse movimento, confirmando assim a hipótese.[22][23][24] O físico francês Jean Perrin baseou-se no trabalho de Einstein para determinar experimentalmente a massa e a dimensão dos átomos, o que constituiu uma forte evidência experimental a favor da teoria atómica de Dalton.[25]
Descoberta do eletrão e do núcleo[editar | editar código-fonte]
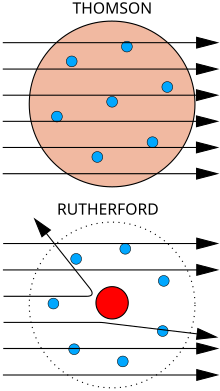
Em cima: os resultados esperados de acordo com o modelo de Thomson; as partículas alfa passariam pelo átomo com desvio irrisório.
Em baixo: os resultados observados, que deram mais tarde origem ao modelo de Rutherford; uma pequena parte das partículas foram desviadas pala concentração de carga positiva do núcleo.
Em 1897 o físico Joseph John Thomson descobriu o eletrão ao trabalhar com raios catódicos em tubos de Crookes. Esta descoberta confirmou a existência de partículas subatómica, o que destruiu o conceito de átomos enquanto unidade indivisíveis.[26] O tubo de Crookes consiste numa ampola que contém apenas vácuo e um dispositivo elétrico que faz os eletrões de qualquer material condutor saltar e formar feixes – os raios catódicos. Thomson descobriu que os raios catódicos são afetados por campos elétricos e magnéticos, deduzindo que a deflexão dos raios catódicos por estes campos são provocados por partículas muito pequenas de carga negativa – os eletrões. Thomson acreditava que os eletrões se encontravam distribuídos pelo átomo, com a respetiva carga elétrica equilibrada pela presença de um mar uniforme de carga positiva – o modelo atómico de Thomson.[27]
No entanto, em 1909, um grupo de investigadores sob a orientação do físico Ernest Rutherford bombardeou uma folha de outro com iões de hélio e descobriu que uma pequena percentagem era defletida com ângulos muito maiores do que aqueles que eram previsíveis segundo o modelo de Thomson. Rutherford interpretou a experiência de Geiger-Marsden, ou experiência da folha de ouro, como uma sugestão de que a carga positiva de um átomo e a maioria da sua massa estavam concentradas num núcleo no centro do átomo, enquanto os eletrões orbitavam à sua volta de forma semelhante aos planetas à volta do sol – o modelo atómico de Rutherford. Os iões de hélio com carga positiva perto deste núcleo denso seriam então defletidos em ângulos muito maiores.[28]
Descoberta dos isótopos[editar | editar código-fonte]
Ao fazer experiências com produtos do decaimento radioativo, em 1913 o radioquímico Frederick Soddy descobriu que parecia existir mais do que um tipo de átomo em cada posição da tabela periódica.[29] O termo isótopo foi cunhado por Margaret Todd para descrever os diferentes átomos que pertencessem ao mesmo elemento. Thomson criou uma técnica para separar os tipos de átomo através do seu trabalho com gases ionizados, o que posteriormente levou à descoberta dos isótopos estáveis.[30]
Modelo de Bohr[editar | editar código-fonte]
Em 1913, o físico Niels Bohr propôs um modelo no qual se assumia que os eletrões de um átomo orbitavam o núcleo, mas que só o podiam fazer ao longo de um conjunto finito de órbitas e que podiam saltar entre estas órbitas apenas através de alterações de energia correspondentes à absorção ou radiação de um fotão.[31] Esta quantificação foi usada para explicar porque é que as órbitas dos eletrões são estáveis (dade que, normalmente, as cargas em aceleração perdem energia cinética que é emitida na forma de radiação eletromagnética – ver radiação sincrotrónica) e porque é que os elementos absorvem e emitem radiação eletromagnética em espectros diferentes.[32]
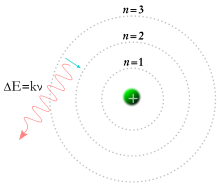
Mais tarde no mesmo ano, Henry Moseley forneceu ainda mais evidências experimentais que sustentavam a teoria de Bohr. Estas evidências reforçavam os modelos de Rutheford e Van den Broek, que propunham que o átomo contém no seu núcleo um número de cargas nucleares positivas igual ao seu número atómico na tabela periódica. Até estas experiências, desconhecia-se que o número atómico fosse uma quantidade física e experimental. Esta equivalência continua a ser o modelo atómico aceite atualmente.[33]
Ligações químicas[editar | editar código-fonte]
As ligações químicas entre átomos foram explicadas por Gilbert Newton Lewis, em 1916, como as interações entre os seus eletrões.[34] Uma vez que já se conhecia que as propriedades químicas dos elementos se repetiam de acordo com a lei periódica,[35] em 1919 o químico norte-americano Irving Langmuir sugeriu que isto podia ser explicado se os eletrões de um átomo estivessem de alguma forma ligados. Assim, pensava-se que os grupos de eletrões ocupavam um conjunto de camadas de eletrões à volta do núcleo.[36]
Física quântica[editar | editar código-fonte]
A experiência de Stern-Gerlach de 1922 forneceu mais evidências da natureza quântica do átomo. Quando um feixe de átomos de prata atravessou um campo magnético especialmente concebido, o feixe dividiu-se com base na direção do momento angular do átomo, ou spin. Uma vez que esta direção é aleatória, era espectável que feixe se propagasse numa linha. Em vez disso, o feixe dividiu-se em duas partes, dependendo se o spin atómico estava orientado para cima ou para baixo.[37]
Com base na proposta de Louis de Broglie de 1924 de que as partículas se comportavam até determinado ponto como ondas, em 1926 Erwin Schrödinger desenvolveu um modelo matemático do átomo que descrevia os eletrões como formas de onda tridimensionais, em vez de partículas pontuais. Uma das consequências de usar formas de onda para descrever os eletrões é que é matematicamente impossível obter valores precisos tanto para a posição como para o momento de determinada partícula ao mesmo tempo. Isto veio a ser conhecido por princípio da incerteza. Segundo este conceito, por cada medição de uma posição só é possível obter uma gama de valores prováveis para o momento, e vice-versa. Embora este modelo fosse difícil de conceber visualmente, foi capaz de explicar alguma observações do comportamento dos átomos que os modelos anteriores não conseguiam, tais como determinados padrões estruturais e espectrais de átomos maiores que o hidrogénio. Assim, o modelo planetário do átomo foi depreciado a favor de um que descrevia as zonas orbitais à volta do núcleo em que fosse mais provável existirem eletrões.[38][39]
Descoberta do neutrão[editar | editar código-fonte]
O desenvolvimento do espectómetro de massa tornou possível medir de forma exata a massa dos átomos. O aparelho usa um íman para desviar a trajetória de um feixe de iões, sendo a quantidade de defleção determinada pela proporção da massa atómica em relação à sua carga. O químico Francis William Aston usou um espectómetro para demonstrar que os isótopos tinham diferentes massas. A massa destes isótopos variava conforme quantidades integrais, o que é denominado "regra do número inteiro".[40] A explicação para estes diferentes isótopos atómicos surgiu apenas com a descoberta em 1932 pelo físico James Chadwick do neutrão – uma partícula de carga neutra com uma massa semelhante ao protão. Até então, os isótopos eram explicados como elementos com o mesmo número de protões, mas diferente número de neutrões no interior do núcleo.[41]
Fissão, alta energia e matéria condensada[editar | editar código-fonte]

Em 1938, o químico alemão Otto Hahn, estudante de Rutherford, direcionou neutrões para átomos de urânio esperando obter elementos transurânicos. Em vez disso, o resultado das suas experiências foi bário.[42] Um ano mais tarde, Lise Meitner e o seu sobrinho Otto Frisch verificaram que os resultados de Hahn foram na realidade a primeira fissão nuclear experimental.[43][44] Na década de 1950, o desenvolvimento de melhores aceleradores de partículas e detectores de partículas permitiu aos cientistas estudar os impactos dos átomos em movimento a alta energia.[45] Verificou-se que os protões e os neutrões eram hadrões, ou compósitos de partículas ainda mais pequenas denominadas quarks. Foram desenvolvidos modelos padrão de física nuclear que explicavam de forma eficaz as propriedades do núcleo em termos destas partículas sub-atómicas e as forças que governavam as interações entre si.[46]
Por volta de 1985, Steven Chu e a sua equipa nos Bell Labs desenvolveram uma técnica para diminuir a temperatura dos átomos usando lasers. No mesmo ano, uma equipa liderada por William Daniel Phillips conseguiu reter átomos de sódio numa armadilha magnética. A conjugação destas duas técnicas e um método baseado no efeito doppler, desenvolvido por Claude Cohen-Tannoudji, permitiu que pequenos grupos de átomos fossem arrefecidos para alguns microkelvins. Isto permitiu que os átomos fossem estudados com elevada precisão, o que mais tarde veio a permitir a descoberta do condensado de Bose-Einstein.[47]
Em termos históricos, os átomos individuais sempre foram proibitivamente pequenos para terem aplicações científicas. No entanto, recentemente têm sido construídos aparelhos que usam um único átomo de metal ligado por ligantes orgânicos para construir um transístor de eletrão único.[48] Têm sido realizadas experiências para reter e abrandar átomos individuais através de arrefecimento a laser, de modo a melhorar a compreensão da matéria.[49]
- Rouvray, Dennis H. (2004). «Elements in the history of the Periodic Table» 2 ed. Endeavour. 28: pp. 69-74. doi:10.1016/j.endeavour.2004.04.006. ISSN 0160-9327
- Giunta, Carmen (1996). «Lavoisier's Elements of Chemistry». Le Moyne College. Consultado em 18 de agosto de 2015</ref>
- ↑ Liddell, Henry George; Scott, Robert. «A Greek-English Lexicon». Perseus Digital Library
- ↑ Liddell, Henry George; Scott, Robert. «ἄτομος». A Greek-English Lexicon. Perseus Digital Library. Consultado em 21 de junho de 2010
- ↑ Haubold, Hans; A.M. Mathai (1998). «Microcosmos: From Leucippus to Yukawa». Structure of the Universe. Consultado em 17 de janeiro de 2008
- ↑ Harrison 2003, pp. 123–139.
- ↑ McEvilley 2002, p. 317.
- ↑ King 1999, pp. 105–107.
- ↑ Teresi 2003, pp. 213–214.
- ↑ a b Ponomarev 1993, pp. 14–15.
- ↑ Siegfried 2002.
- ↑ Rouvray 2004.
- ↑ Giunta 1996.
- ↑ «78 Platinum». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «28 Nickel». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «12 Magnesium». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ «08 Oxygen». Elements.vanderkrogt.net. Consultado em 12 de setembro de 2008
- ↑ Cook, Gerhard A.; Lauer, Carol M. (1968). «Oxygen». In: Clifford A. Hampel. The Encyclopedia of the Chemical Elements. Nova Iorque: Reinhold Book Corporation. pp. 499–500. LCCN 68-29938
- ↑ Wurtz 1881, pp. 1–2.
- ↑ Tolentino, Mario; Rocha-Filho, Romeu C.; Chagas, Aécio Pereira (1997). «Alguns aspectos históricos da classificação periódica dos elementos químicos» (PDF) 1 ed. Química Nova. 20: pp. 103-117. ISSN 0100-4042
- ↑ Roscoe 1895, pp. 129.
- ↑ Horvitz, Leslie (2002). Eureka!: Scientific Breakthroughs That Changed The World. Nova Iorque: John Wiley. p. 43. ISBN 978-0-471-23341-1. OCLC 50766822
- ↑ Venable, F P (1896). The development of the periodic law. Easton: Chemical Publishing Company. pp. 96–97, 100–102
- ↑ Mazo 2002, pp. 1–7.
- ↑ Einstein, Albert (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen» (PDF). Annalen der Physik (em alemão). 322 (8): 549–560. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806. Consultado em 4 de fevereiro de 2007
- ↑ Lee, Y.K.; Hoon, K. (1995). «Brownian Motion». Imperial College. Consultado em 18 de dezembro de 2007. Cópia arquivada em 18 dezembro 2007
- ↑ Patterson, G. (2007). «Jean Perrin and the triumph of the atomic doctrine». Endeavour. 31 (2): 50–53. PMID 17602746. doi:10.1016/j.endeavour.2007.05.003
- ↑ The Nobel Foundation. «J.J. Thomson». Consultado em 19 de agosto de 2015
- ↑ The Columbia Electronic Encyclopedia, 6ª ed. (2012). «Crookes tube». Consultado em 31 de março de 2014
- ↑ Rutherford, E. (1911). «The Scattering of α and β Particles by Matter and the Structure of the Atom». Philosophical Magazine. 21: 669–88
- ↑ Nobel Foundation. «Frederick Soddy, The Nobel Prize in Chemistry 1921». Consultado em 18 de agosto de 2015
- ↑ Thomson, Joseph John (1913). «Rays of positive electricity». Proceedings of the Royal Society. A 89: 1–20
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomestern20050516 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomebohr19221211 - ↑ Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. Nova Iorque: Oxford University Press. pp. 228–230. ISBN 0-19-851971-0
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomejacs38_4_762 - ↑ Scerri, Eric R. (2007). The periodic table: its story and its significance. [S.l.]: Oxford University Press US. pp. 205–226. ISBN 0-19-530573-6
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomejacs41_6_868 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomefop17_6_575 - ↑ Brown, Kevin (2007). «The Hydrogen Atom». MathPages. Consultado em 21 de dezembro de 2007
- ↑ Harrison, David M. (Março de 2000). «The Development of Quantum Mechanics». University of Toronto. Consultado em 21 de dezembro de 2007
- ↑ Aston, Francis W. (1920). «The constitution of atmospheric neon». Philosophical Magazine. 39 (6): 449–55
- ↑ Chadwick, James. «Nobel Lecture: The Neutron and Its Properties». Nobel Foundation. Consultado em 21 de dezembro de 2007
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomehahn_meitner_strassmann - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomenature143_3615_239 - ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomeschroeder - ↑ Kullander, Sven. «Accelerators and Nobel Laureates». The Nobel Foundation. Consultado em 31 de janeiro de 2008
- ↑ The Nobel Foundation. «The Nobel Prize in Physics 1990». Consultado em 31 de janeiro de 2008
- ↑ Nobel Foundation. «The Nobel Prize in Physics 1997». Consultado em 10 de fevereiro de 2008
- ↑ Park, Jiwoong; et al. (2002). «Coulomb blockade and the Kondo effect in single-atom transistors». Nature. 417 (6890): 722–25. doi:10.1038/nature00791
- ↑ Domokos, P.; Janszky, J.; Adam, P. (1994). «Single-atom interference method for generating Fock states». Physical Review A. 50: 3340–44. doi:10.1103/PhysRevA.50.3340
