Voltamperometria


A voltamperometria é uma categoria dos métodos eletroanalíticos usados na Química Analítica e em vários processos industriais. Na voltamperometria, a informação sobre um analito é obtida medindo a corrente quando se modifica o potencial.[1]
Sistema de três eletrodos[editar | editar código-fonte]
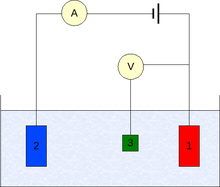
Os experimentos de voltamperometria investigam a reatividade na semicélula de um analito. A maioria dos experimentos controlam o potencial (Volts) de um eletrodo em contato com o analito, enquanto se mede a corrente resultante (Ampere).
Para iniciar um experimento precisa-se ao menos dois eletrodos. O eletrodo de trabalho, que faz contato com o analito, deve aplicar o potencial desejado de uma maneira controlada e facilitar a transferência de elétrons para o analito. Um segundo eletrodo atua como a outra semicélula. Este segundo eletrodo deve ter um potencial conhecido com o que medir o potencial do eletrodo de trabalho, além do mais, devem-se equilibrar os eletrodos adicionados ou eliminados pelo eletrodo de trabalho. Se bem esta é uma configuração viável, tem uma série de deficiências. Mas significativamente, é extremadamente difícil para um eletrodo manter um potencial constante enquanto se passa a corrente para fazer frente aos eventos redox do eletrodo de trabalho.
Para resolver este problema, o papel de provedor de corrente e o de tensão de referência foi dividido entre dois eletrodos separados. O eletrodo de referência é una semicélula com um potencial de redução conhecido. Sua única função é atuar como referência na medição e controlar o potencial dos eletrodos de trabalho e em nenhum momento passa nenhuma corrente. O eletrodo auxiliar passa toda a corrente necessária para equilibrar a corrente observada no eletrodo de trabalho. Para alcançar esta corrente, o auxiliar frequentemente oscila a potenciais extremos nos limites da faixa do solvente, onde se oxida ou reduz o solvente ou eletrólito de apoio. Esses eletrodos, o de trabalho, o de referência, e o auxiliar constituem o moderno sistema de três eletrodos.
Há muitos sistemas que tem mais eletrodos, mas seus princípios de funcionamentos são geralmente os mesmos do sistema de três eletrodos. Por exemplo, o eletrodo de disco-anel rotatório tem dois eletrodos de trabalho diferentes e separados, um disco e um anel, que pode ser uado para varrer e manter potenciais independentes um do outro. Ambos os eletrodos estão equilibrados por uma simples combinação do de referência e o auxiliar para formar um circuito de quatro eletrodos. Experimentos mais complicados podem utilizar tantos eletrodos de trabalho quanto necessitar e as vezes eletrodos de referência e auxiliar.
Na prática pode ser muito importante contar com um eletrodo de trabalho com características de dimensões e superfície conhecidas. Como resultado disso, é comum limpar e polir os eletrodos de trabalho com regularidade. O eletrodo auxiliar pode ser quase qualquer coisa com tal que não reaja com a maior parte da solução do analito e conduza bem. O de referência é o mais completo dos três eletrodos, utiliza uma variedade de padrões e que vale a pena investigar. Para trabalhos não aquosos, a IUPAC recomenda o uso da dupla ferroceno/ferrocênio como um padrão interno. Na maioria dos experimentos de voltamperometria um eletrólito inerte (também conhecido como eletrólito suporte) é utilizado para reduzir ao mínimo a resistência da solução. Pode ser possível realizar um experimento sem um eletrólito suporte, mas a resistência alcançada reduz enormemente a precisão dos resultados. No caso de líquidos iônicos a temperatura ambiente iônico o solvente pode atuar como eletrólito.
Teoria[editar | editar código-fonte]
A análise de dados requer a consideração da cinética, além da termodinâmica, devido ao elemento temporal da voltamperometria. Idealizadas relações termodinâmicas eletroquímicas teóricas, tal como a equação de Nernst estão elaboradas sem um componente de tempo. Ainda que esses modelos se mostrem insuficientes por si mesmos para descrever os aspectos dinâmicos da voltamperometria, modelos como a equação de Nernst e a equação de Butler-Volmer estabelecem as bases para as relações de voltamperometria modificadas que relacionam a teoria com os resultados observados.
Tipos de voltamperometria[editar | editar código-fonte]
- Voltamperometria de varredura linear
- Voltamperometria escalonada
- Voltamperometria de onda quadrada
- Voltamperometria cíclica - Um método voltamétrico que pode-se utilizar para determinar os coeficientes de difusão e os potenciais de redução de semicélulas.
- Voltamperometria de redissolução anódica – Um método de análise quantitativo para a análise de traços de cátions metálicos. O analito se deposita ( eletroliticamente) sobre o eletrodo de trabalho durante uma etapa de deposição, e logo se oxida durante la etapa de extração. A corrente é medida durante a etapa de extração.
- Voltamperometria de redissolução catódica – Um método de análise quantitativo para a análise de traços de ânions. Quando se aplica um potencial positivo, se produz a oxidação do eletrodo de mercúrio e a formação de precipitados insolúveis dos ânions. Um potencial negativo reduz então (tiras) da película depositada na solução.
- Voltamperometria de redissolução de adsorção – Um método de análise quantitativo para a análise de traços. O analito se deposita simplesmente por adsorção na superfície do eletrodo (isto é, sem eletrólise), e logo se eletrolisa para dar o sinal analítico. Utilizam-se muitas vezes eletrodos modificados quimicamente.
- Voltamperometria de corrente alterna
- Polarografia – Uma subclasse de voltamperometria onde o eletrodo de trabalho é um eletrodo de gota de mercúrio (MDE), útil por seu amplo intervalo catódico e superfície renovável.
- Voltamperometria de eletrodo rotatório – Uma técnica hidrodinâmica na que o eletrodo de trabalho, usualmente um electrodo de disco rotatório (RDE) ou o eletrodo de disco-anel rotatório (RRDE), roda a uma velocidade muito alta. Esta técnica é útil para estudar a cinética e os mecanismos de reação eletroquímicos para uma semirreação.
- Voltamperometria de pulso normal
- Voltamperometria de pulso diferencial
- Cronoamperometria
História[editar | editar código-fonte]
O começo da voltamperometria se viu facilitado pelo descobrimento da polarografia em 1922 pelo Premio Nobel de Química, Jaroslav Heyrovský. As primeiras técnicas de voltamperimétricas tiveram muitos problemas, que limitavam sua viabilidade para o uso diário na química analítica. Em 1942, Hickling construiu o primeiro potenciostato de três eletrodos. Os anos 1960 e 1970 foram testemunhas de muitos avanços na teoria, a instrumentação, e a introdução de sistemas acrescentados e controlados por computadores. Estes avanços melhoraram a sensibilidade e criaram novos métodos analíticos. A indústria respondeu com a produção mais barata de potenciostatos, de eletrodos, e das células que poderiam ser utilizados eficazmente no trabalho analítico de rotina.
Aplicações[editar | editar código-fonte]
Sensores voltamperométricos
Comercialmente produzem-se um grande número de sistemas de voltamperométricos pela determinação de determinadas espécies que são de interesse na indústria e a investigação. Esses dispositivos se denominam as vezes eletrodos, mas são, de fato, células voltamperométricas completas e são mais conhecidas como sensores.
Eletrodo de oxigênio
A determinação de oxigênio dissolvido em uma variedade de ambientes aquáticos, como a água de mar, o sangue, as águas residuais, os efluentes de plantas químicas, e os solos é de enorme impotância para a indústria, a investigação biomédica e de meio ambiente, e a medicina clínica. Um dos métodos mais comuns e convenientes para fazer estas medições é o sensor de Clark, que foi patentado por L.C. Clark, Jr. em 1956.
Referências
- ↑ Kissinger, Peter; William R. Heineman (23 de janeiro de 1996). Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded 2 ed. [S.l.]: CRC. ISBN 0-8247-9445-1
