2-Piridona
| 2-Pyridone Alerta sobre risco à saúde | |
|---|---|

| |
|
|
| Nome IUPAC | 2-Pyridone |
| Outros nomes | 2(1H)-Pyridinone, 2(1H)-Pyridone, 1-H-Pyridine-2-one, 1,2 Dihydro-2-oxopyridine, 1H-2-Pyridone, 2-Oxopyridone, 2-Pyridinol, 2-Hydroxypyridine |
| Identificadores | |
| Número CAS | |
| ChemSpider | |
| ChEBI | |
| Número RTECS | UV1144050 |
| SMILES |
|
| InChI | 1/C5H5NO/c7-5-2-1-3-6-4-5/h1-4,7H
|
| Propriedades | |
| Fórmula molecular | C5H5NO |
| Massa molar | 95.10 g/mol |
| Aparência | Sólido cristalino incolor |
| Densidade | 1.39 g/cm³, sólido |
| Ponto de fusão |
107.8 °C (381.0 K) |
| Ponto de ebulição |
280 °C (553.2 K) decomposição |
| Solubilidade em Outros solventes | Solúvel em água, metanol, acetona |
| Acidez (pKa) | 11.65 |
| λmax | 293 nm (ε 5900, H2O soln) |
| Estrutura | |
| Estrutura cristalina | Ortorrômbico |
| Forma molecular | planar |
| Momento dipolar | 4.26 D |
| Riscos associados | |
| Principais riscos associados |
irritante |
| NFPA 704 | |
| Frases R | R36 R37 R38 |
| Frases S | S26 |
| Ponto de fulgor | 210 °C |
| Compostos relacionados | |
| Outros aniões/ânions | 2-Piridinolato |
| Outros catiões/cátions | Íon 2-hidroxipiridinium |
| Grupos funcionais relacionados | álcool, lactama, lactima, piridina, cetona |
| Compostos relacionados | piridina, timina, citosina, uracila, benzeno |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
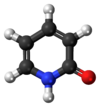
2-Piridona é um composto orgânico com a fórmula C5H4NH(O). Este sólido cristalino incolor é usado em síntese de peptídeos. É bem conhecido como formando estruturas de ligação de hidrogênio um pouco relacionadas com o mecanismo de emparelhamento de bases encontrada no RNA e DNA. É também um caso clássico de uma molécula que existe como tautômeros.
Estrutura
[editar | editar código-fonte]A característica mais proeminente de 2-piridona é o grupo amida, um nitrogênio com um hidrogênio ligado a ele e com o grupo ceto ao lado dele. Em péptidos, os aminoácidos estão ligados por este padrão, uma característica responsável por algumas das propriedades físicas e químicas notáveis. Nesta e moléculas semelhantes, o hidrogênio ligado ao nitrogênio é adequado para formar uma forte ligação de hidrogênio noutro nitrogênio e oxigênio contido na espécie.
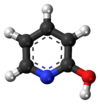
Tautomerismo
[editar | editar código-fonte]A forma predominante em estado sólido é a 2-piridona. Isso foi confirmado por cristalografia de raios-X, que mostra que o hidrogênio no estado sólido está mais próximo do nitrogênio do que do oxigênio (devido à baixa densidade de elétrons no hidrogênio, o posicionamento exato é difícil) e Espectroscopia no infravermelho, que mostra que a frequência longitudinal C = O está presente enquanto as frequências OH estão ausentes.[1][2][3][4][5][6][7][8][9][10][11][12][13]
Referências
- ↑ Yang H. W.; Craven B. M. (1998). «Charge Density of 2-Pyridone». Acta Crystallogr. B. 54 (6): 912–920. PMID 9880899. doi:10.1107/S0108768198006545
- ↑ Penfold B. R. (1953). «The Electron Distribution in Crystalline Alpha Pyridone». Acta Crystallogr. 6 (7): 591–600. doi:10.1107/S0365110X5300168X
- ↑ Ohms U.; Guth H.; Heller E.; Dannöhl H.; Schweig A. (1984). «Comparison of Observed and Calculated Electron-Density 2-Pyridone, C5H5NO, Crystal-Structure Refinements at 295K and 120K, Experimental and Theoretical Deformation Density Studies». Z. Kristallogr. 169: 185–200. doi:10.1524/zkri.1984.169.14.185
- ↑ Almlöf J.; Kvick A.; Olovsson I. (1971). «Hydrogen Bond Studies Crystal Structure of Intermolecular Complex 2-Pyridone-6-Chloro-2-Hdroxypyridine». Acta Crystallogr. B. 27 (6): 1201–1208. doi:10.1107/S0567740871003753
- ↑ Engdahl K., Ahlberg P. (1977). Journal Chemical Research: 340–341 Em falta ou vazio
|título=(ajuda) - ↑ Bensaude O, Chevrier M, Dubois J (1978). «Lactim-Lactam Tautomeric Equilibrium of 2-Hydroxypyridines. 1.Cation Binding, Dimerization and Interconversion Mechanism in Aprotic Solvents. A Spectroscopic and Temperature-Jump Kinetic Study». J. Am. Chem. Soc. 100 (22): 7055–7066. doi:10.1021/ja00490a046
- ↑ Bensaude O, Dreyfus G, Dodin G, Dubois J (1977). «Intramolecular Nondissociative Proton Transfer in Aqueous Solutions of Tautomeric Heterocycles: a Temperature-Jump Kinetic Study». J. Am. Chem. Soc. 99 (13): 4438–4446. doi:10.1021/ja00455a037
- ↑ Bensaude O, Chevrier M, Dubois J (1978). «Influence of Hydration upon Tautomeric Equilibrium». Tetrahedron Lett. 19 (25): 2221–2224. doi:10.1016/S0040-4039(01)86850-7
- ↑ Hammes GG, Park AC (1969). «Kinetic and Thermodynamic Studies of Hydrogen Bonding». J. Am. Chem. Soc. 91 (4): 956–961. doi:10.1021/ja01032a028
- ↑ Hammes GG, Spivey HO (1966). «A Kinetic Study of the Hydrogen-Bond Dimerization of 2-Pyridone». J. Am. Chem. Soc. 88 (8): 1621–1625. PMID 5942979. doi:10.1021/ja00960a006
- ↑ Beak P, Covington JB, Smith SG (1976). «Structural Studies of Tautomeric Systems: the Importance of Association for 2-Hydroxypyridine-2-Pyridone and 2-Mercaptopyridine-2-Thiopyridone». J. Am. Chem. Soc. 98 (25): 8284–8286. doi:10.1021/ja00441a079
- ↑ Beak P, Covington JB, White JM (1980). «Quantitave Model of Solvent Effects on Hydroxypyridine-Pyridone and Mercaptopyridine-Thiopyridone Equilibria: Correlation with Reaction-Field and Hydrogen-Bond Effects». J. Org. Chem. 45 (8): 1347–1353. doi:10.1021/jo01296a001
- ↑ Beak P, Covington JB, Smith SG, White JM, Zeigler JM (1980). «Displacement of Protomeric Equilibria by Self-Association: Hydroxypyridine-Pyridone and Mercaptopyridine-Thiopyridone Isomer Pairs». J. Org. Chem. 45 (8): 1354–1362. doi:10.1021/jo01296a002

