Alexander Dianin
Alexander Pavlovich Dianin ( em russo: Александр Павлович Дианин ; 20 de abril de 1851 - 6 de dezembro de 1918) era um químico russo de São Petersburgo. Ele realizou estudos sobre fenóis e descobriu um derivado de fenol agora conhecido como bisfenol A[1][2] e o composto de Dianin em conformidade.[3] Ele era casado com a filha adotiva do colega químico Alexander Borodin. Em 1887, Dianin sucedeu seu sogro como presidente do Departamento de Química da Academia Médico-Cirúrgica Imperial de São Petersburgo (agora a Academia Médica Militar SM Kirov ).
Bisfenol A e composto de Dianin
[editar | editar código-fonte]O método de Dianin para preparar o bisfenol A de 1891[1] continua sendo a abordagem mais conhecida para este importante composto embora o método tenha sido refinado para síntese em escala industrial.[4] Envolve a condensação catalisada de uma mistura 2:1 de fenol e acetona na presença de ácido clorídrico concentrado ou ácido sulfúrico. A reação ocorre prontamente à temperatura ambiente, produzindo um produto bruto contendo uma grande variedade de produtos secundários (incluindo o composto de Dianin ) em questão de horas.[5] A equação geral é simples, com a água como único subproduto:
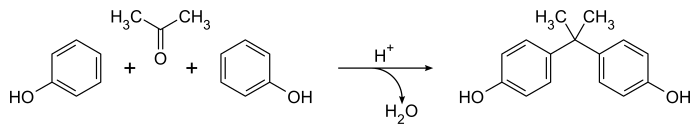
Mecanisticamente, o catalisador ácido converte a acetona em um íon carbênium que passa por uma reação eletrofílica de substituição aromática com o fenol, produzindo predominantemente produtos para- substituídos. Uma segunda espécie de carbênium é produzida por protonação e perda do grupo hidroxila alifático, levando ao bisfenol A (4,4'-isopropilidenodifenol) após uma segunda reação de substituição aromática. O processo não é muito seletivo e é conhecido um grande número de produtos menores e reações colaterais.[5]

Os produtos secundários que são isômeros do bisfenol A resultam da formação de produtos substituídos orto e incluem os isômeros 2,2'- e 2,4'- do isopropilidenodifenol. Outras reações colaterais incluem a formação de trifenol I, 4,4 '- (4-hidroxi- m- fenilenodiisopropilideno) difenol, do ataque de um eletrófilo de carbênium a uma molécula de bisfenol A e a formação de trifenol II, 4,4', 4 '' - (2-metil-2-pentanil-4-ilideno) trifenol, quando uma reação de eliminação converte o carbênio em uma olefina reativa.[5] A dimerização catalisada de acetona por meio de uma condensação de aldol é bem conhecida e produz álcool diacetona e (por desidratação ) óxido de mesitil em condições ácidas[6] e básicas. A geração in situ de óxido de mesitil adiciona outra olefina reativa à mistura. Nos casos em que uma fração olefínica pode interagir com um grupo hidroxila fenólico (normalmente como resultado da substituição orto- orbital), ocorrem reações rápidas de ciclização produzindo flavans e cromans. Esta é a fonte do composto de Dianin na mistura, e Dianin posteriormente demonstrou que o composto pode ser produzido com um rendimento muito maior reagindo o fenol diretamente com o óxido de mesitil.[3] Trabalhos posteriores mostraram que a produção de bisfenol A pode ser muito mais seletiva usando uma mistura de reação com um excesso considerável de fenol em vez de uma composição estequiométrica 2:1, suprimindo bastante as reações colaterais.[4]
Leitura adicional
[editar | editar código-fonte]- Dianin, Sergey Aleksandrovich (1980). Borodin. Greenwood Press. Westport: [s.n.] ISBN 9780313225291. OCLC 247826062
- Figurovskiy, Nikolay Aleksandrovich; Soloviev, Yuriy Ivanovich (1988). Aleksandr Porfirievich Borodin: a chemist's biography. Springer-Verlag. New York: [s.n.] ISBN 9780387178882. OCLC 16647830
Referências
- ↑ a b Dianin (1891). «О продуктах конденсации кетонов с фенолами». Журнал Русского Физико-Химического Общества (J. Russ. Phys. Chem. Soc.) (em russo). 23: 488–517, 523–546, 601–611
- ↑ Zincke (1905). «Ueber die Einwirkung von Brom und von Chlor auf Phenole: Substitutionsprodukte, Pseudobromide und Pseudochloride». Justus Liebigs Annalen der Chemie (em alemão). 343: 75–99. doi:10.1002/jlac.19053430106
- ↑ a b Dianin (1914). «Condensation of phenol with unsaturated ketones. Condensation of phenol with mesityl oxide». Журнал Русского Физико-Химического Общества (J. Russ. Phys. Chem. Soc.) (em russo). 36: 1310–1319
- ↑ a b Ullmann's Encyclopedia of Industrial Chemistry. 2000. ISBN 3527306730
- ↑ a b c Encyclopedia of Chemical Processing and Design. 4. Marcel Dekker. 1977. pp. 406–430. ISBN 9780824724542
- ↑ Weissermel, Klaus; Arpe, Hans-Jürgen (2003). «Secondary Products of Acetone». Industrial Organic Chemistry. John Wiley & Sons 4th ed. [S.l.: s.n.] pp. 281–288. ISBN 9783527305780
