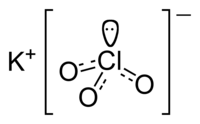
Clorato de potássio
Clorato de potássio é um composto químico que contém potássio, cloro e oxigénio, com fórmula KClO3. Na sua forma pura, é uma substância cristalina branca. É o mais comum clorato com aplicações industriais, e é normalmente encontrado em laboratórios bem abastecidos.
Usos
[editar | editar código-fonte]É usado normalmente em:
- como um agente oxidante,
- para produzir oxigénio
- énio (especialmente em laboratórios),
- como um desinfetante,
- em fósforos de segurança, e
- em explosivos e fogos de artifício.
Explosivos
[editar | editar código-fonte]O clorato de potássio foi um ingrediente chave em antigas espoletas (primers, cápsulas de percussão) de armas de fogo chamado então de clorato de potassa. Ele continua sendo utilizado nesta aplicação, quando não suplantado pelo perclorato de potássio.
Propelentes baseados em clorato são mais eficientes que a pólvora tradicional e são menos suscetíveis a serem prejudicados pelo contato com água. Entretanto, eles são extremamente instáveis na presença de enxofre ou fósforo e são muito mais dispendiosos.
Propelentes de clorato devem ser usados somente em equipamentos desenhados para eles; falhas em seguir esta precaução é uma comum fonte de acidentes. O clorato de potássio, frequentemente em combinação com fulminato de prata, é usado em pequenos fogo de artifício conhecidos (no Brasil) como "estalos" ou "traques".
Quando misturado com outros materiais, pode formar altos explosivos. O higroscópico e levemente mais fraco clorato de sódio é algumas vezes usado como um mais seguro e menos dispendioso substituto para o clorato de potássio. Na Segunda Guerra Mundial, misturas de clorato de potássio com plastificantes (tais como ceras) foram o mais comum tipo de explosivos plásticos usados, frequentemente preenchendo granadas e outras munições. Quando usado em explosivos como um oxidante, o explosivo é classificável como "baixo" devido a sua característica de queimar rapidamente mais do que propriamente explodir. Quando misturado com um plastificante, ele torna-se um "alto explosivo", requerendo uma cápsula de detonação para detonar-se adequadamente. Clorato de potássio é também usado em algumas fórmulas de pólvora, geralmente substituindo o menos poderoso nitrato de potássio.O clorato de potássio foi um ingrediente chave em antigas espoletas (primers, cápsulas de percussão) de armas de fogo chamado então de clorato de potassa. Ele continua sendo utilizado nesta aplicação, quando não suplantado pelo perclorato de potássio.
Propelentes baseados em clorato são mais eficientes que a pólvora tradicional e são menos suscetíveis a serem prejudicados pelo contato com água. Entretanto, eles são extremamente instáveis na presença de enxofre ou fósforo e são muito mais dispendiosos.
Propelentes de clorato devem ser usados somente em equipamentos desenhados para eles; falhas em seguir esta precaução é uma comum fonte de acidentes. O clorato de potássio, frequentemente em combinação com fulminato de prata, é usado em pequenos fogo de artifício conhecidos (no Brasil) como "estalos" ou "traques".
Quando misturado com outros materiais, pode formar altos explosivos. O higroscópico e levemente mais fraco clorato de sódio é algumas vezes usado como um mais seguro e menos dispendioso substituto para o clorato de potássio. Na Segunda Guerra Mundial, misturas de clorato de potássio com plastificantes (tais como ceras) foram o mais comum tipo de explosivos plásticos usados, frequentemente preenchendo granadas e outras munições. Quando usado em explosivos como um oxidante, o explosivo é classificável como "baixo" devido a sua característica de queimar rapidamente mais do que propriamente explodir. Quando misturado com um plastificante, ele torna-se um "alto explosivo", requerendo uma cápsula de detonação para detonar-se adequadamente. Clorato de potássio é também usado em algumas fórmulas de pólvora, geralmente substituindo o menos poderoso nitrato de potássio.
Em laboratório
[editar | editar código-fonte]Clorato de potássio frequentemente usado em laboratórios de ensino secundário e superior para produzir oxigénio na forma de gás; ele é uma fonte mais barata que oxigénio pressurizado ou criogénico. Clorato de potássio irá facilmente decompor-se quando aquecido em contato com um catalisador, tipicamente o dióxido de manganês (IV) (MnO2). Então, ele pode ser simplesmente colocado em um tubo de ensaio e aquecido por um queimador. Se o tubo é equipado com uma rolha perfurada e um tubo de escoamento dos gases produzidos, o oxigénio será produzido e estará disponível na saída do sistema, para qualquer reação em que se o necessite. A reação é a seguinte:
- 2 KClO3(s) → 2 KCl(s) + 3 O2(g)
A realização segura desta reação requer reagentes muito puros e cuidadoso controle de temperatura. Clorato de potássio fundido é um oxidante extremamente poderoso e irá espontaneamente reagir com muitos materiais comuns. Explosões tem sido resultantes de clorato líquido que salpicou nos tubos de látex ou PVC de geradores de oxigénio laboratoriais, assim como contato do clorato de potássio com hidrocarbonetos das graxas e pastas de vedações e lubrificações das montagens com rolhas e outros. Impurezas no clorato de potássio mesmo podem também causar problemas. Quando trabalhando com uma nova amostra (partida, batelada) de clorato de potássio, é recomendável tomar uma pequena amostra (aproximadamente 1 grama) e aquecê-la fortemente em uma cápsula de porcelana aberta. Contaminações podem levar esta pequena amostra a explodir, indicando que esta partida de clorato deve ser descartada para o uso com este fim.
Como agente oxidante
[editar | editar código-fonte]- Clorato de potássio reage com enxofre resultando em cloreto de potássio e dióxido de enxofre.
- A reação com carbono (como na forma de carvão) resulta em dióxido de carbono.
Na produção de oxigénio
[editar | editar código-fonte]Clorato de potássio é usado nos sistemas de fornecimento de oxigénio de aeronaves, e foi responsável por pelo menos, comprovadamente, um acidente aéreo. Um incêndio na estação espacial MIR foi associado a esta substância. A decomposição do clorato de potássio também foi usada no passado para a iluminação de palcos de teatros.
Como pesticida
[editar | editar código-fonte]Clorato de potássio é usado também como um pesticida. Na Finlândia é vendido sob o nome de Fegabit. Finlândia também usou clorato de potássio como o principal ingrediente - aproximadamente 60% – de uma aperfeiçoada versão do coquetel Molotov.
Segurança
[editar | editar código-fonte]O clorato de potássio deve ser manuseado com cuidado. Ele reage vigorosamente, e em alguns casos sofre ignição ou explode, quando misturado com diversos materiais combustíveis. Enxofre deve ser evitado em composições de pólvora contendo clorato de potássio, já que estas misturas são propensas a deflagração espontânea.
Produção
[editar | editar código-fonte]Em escala industrial, o clorato de potássio é produzido pela eletrólise de solução de cloreto de sódio para formar clorato de sódio, o qual é reagido com cloreto de potássio para precipitar clorato de potássio. O cloreto de sódio resultante retorna ao licor mãe para eletrólise.
- 2 NaOH + Cl2 → NaCl + NaOCl + H2O
- 3 NaOCl → 2 NaCl + NaClO3
- NaClO3 + KCl → NaCl + KClO3
KClO3 pode também ser produzido em uma menor escala pela desproporcionalização térmica de um hipoclorito a seu respectivo clorato e cloreto por ebulição, então adicionando KCl. Esta reação deve ser realizada em uma capela laboratorial devido a produção de gases cloro e dióxido de cloro. A insolubilidade do clorato de potássio torna-o fácil de separar de contaminantes solúveis, mas relativamente difícil de separar de insolúveis, como materiais dos eletrodos ou das células de eletrólise.
Pode ser obtido da reação do cloro sobre solução de hidróxido de potássio:
Ver também
[editar | editar código-fonte]Referências
[editar | editar código-fonte]- "Chlorate de potassium. Chlorate de sodium", Fiche toxicol. n° 217, Paris:Institut national de recherche et de sécurité, 2000. 4pp.
- «Continuous process for the manufacture of potassium chlorate by coupling with a sodium chlorate production plant» (em inglês)