Hidrogénio
O hidrogénio (português europeu) ou hidrogênio (português brasileiro) (pronuncia-se /idɾɔˈʒɛnju/ ou /idɾoˈʒenju/ de hidro + génio/gênio, ou do fr. hidrogène e admitindo-se a grafia dupla pelo acordo ortográfico[1]) é um elemento químico com número atómicoPE ou atômico PB 1, representado pelo símbolo H. Com uma massa atómica de aproximadamente 1,0 u, o hidrogénio é o elemento menos denso. Ele geralmente apresenta-se em sua forma molecular, formando o gás diatômico (H2) nas condições normais de temperatura e pressão (CNTP). Este gás é inflamável, incolor, inodoro e insolúvel em água.[2] O hidrogénio, por possuir propriedades distintas, não se enquadra claramente em nenhum grupo da tabela periódica, sendo muitas vezes colocado no grupo 1 (anteriormente chamado de 1A) por possuir apenas 1 eletrão na camada de valência (ou última camada).[3]
O hidrogénio é o mais abundante dos elementos químicos, constituindo aproximadamente 75% da massa elementar do Universo.[4] [nota 1] Estrelas na sequência principal são compostas primariamente de hidrogénio em seu estado de plasma. O Hidrogénio elementar é relativamente raro na Terra, e é industrialmente produzido a partir de hidrocarbonetos presentes no gás natural, tais como metano, após o qual a maior parte do hidrogénio elementar é usada "em cativeiro" (o que significa localmente no lugar de produção). Os maiores mercados do mundo usufruem do uso do hidrogénio para o aprimoramento de combustíveis fósseis (no processo de hidrocraqueamento) e na produção de amoníaco (maior parte para o mercado de fertilizantes). O hidrogénio também pode ser obtido por meio da eletrólise da água, porém este processo é atualmente dispendioso, o que privilegia sua obtenção a partir do gás natural.[5]
O isótopo do hidrogênio que possui maior ocorrência, conhecido como prótio, é formado por um único protão, não possuindo nenhum neutrão. Em compostos iônicos pode ter uma carga positiva (se tornando um catião) ou uma carga negativa (se tornando o anião conhecido como hidreto). Também pode formar outros isótopos, como o deutério, com apenas um neutrão, e o trítio, com dois neutrões. Em 2001, foi criado em laboratório o isótopo 4H e, a partir de 2003, foram sintetizados os isótopos 5H até 7H.[6][7] O elemento hidrogénio forma compostos com a maioria dos elementos, está presente na água e na maior parte dos compostos orgânicos. Possui um papel particularmente importante na química ácido-base, na qual muitas reações envolvem a troca de prótons entre moléculas solúveis. Como o único átomo neutro pelo qual a Equação de Schrödinger pode ser resolvida analiticamente, o estudo energético e de ligações do átomo hidrogênio teve um papel principal no desenvolvimento da mecânica quântica.
A solubilidade e características do hidrogénio com vários metais são muito importantes na metalurgia (uma vez que muitos metais podem sofrer fragilidade em sua presença)[8] e no desenvolvimento de maneiras seguras de estocá-lo para uso como combustível.[9] É altamente solúvel em diversos compostos que possuem Terras-raras e metais de transição[10] e pode ser dissolvido tanto em metais cristalinos e amorfos.[11] A solubilidade do hidrogénio em metais é influenciada por distorções ou impurezas locais na estrutura cristalina do metal.[12]
História
[editar | editar código-fonte]Origem e evolução
[editar | editar código-fonte]Segundo a teoria Alpher-Bethe-Gamov, o hidrogénio formou-se na época da nucleossíntese primordial, quando o Universo expandiu e arrefeceu o suficiente para permitir a ligação entre eletrões e protões.[13] O deutério formou-se por captura de neutrões.[13] A junção de mais neutrões e subsequente decaimento levou à formação de hélio e lítio. Uma parte de elementos mais pesados foi formada, mas a principal fonte destes elementos provém da nucleossíntese estelar.
Descoberta e uso
[editar | editar código-fonte]O gás hidrogénio, H2, foi o primeiro produzido artificialmente e formalmente descrito por T. Von Hohenheim (também conhecido como Paracelso, 1493–1541) por meio da reação química entre metais e ácidos fortes.[14] Paracelso não tinha o conhecimento de que o gás inflamável produzido por esta reação química era constituído por um novo elemento químico. Em 1671, Robert Boyle redescobriu e descreveu a reação entre limalhas de ferro e ácidos diluídos, o que resulta na produção de gás hidrogênio.[15] Em 1766, Henry Cavendish foi o primeiro a reconhecer o gás hidrogênio como uma discreta substância, ao identificar o gás de uma reação ácido-metal como "ar inflamável" e descobrindo mais profundamente, em 1781, que o gás produz água quando queimado. A ele geralmente é dado o crédito pela sua descoberta como um elemento químico.[16][17] Em 1783, Antoine Lavoisier deu ao elemento o nome de hidrogênio (do grego υδρώ (hydro), água e γένος-ου (genes), gerar)[18] quando ele e Laplace reproduziram a descoberta de Cavendish, onde água é produzida quando hidrogênio é queimado.[17]
Lavoisier produziu hidrogénio pelas suas experiências sobre conservação de massa fazendo reagir um fluxo de vapor de metal por meio de um tubo de ferro aquecida ao fogo. A oxidação anaeróbica de ferro pelos protões da água a alta temperatura pode ser esquematicamente representada pelo conjunto das seguintes reações:
- Fe + H2O → FeO + H2
- 2 Fe + 3 H2O → Fe2O3 + 3 H2
- 3 Fe + 4 H2O → Fe3O4 + 4 H2
Muitos metais, tais como o zircónio são submetidos a uma reacção semelhante com água o que conduz à produção de hidrogénio.
A primeira célula de combustível foi desenvolvida em fins da década de 1830 por William Robert Grove.[19][20] Em 1932, Francis Thomas Bacon desenvolveu com sucesso uma célula de combustível estacionária de 5 kW.[21] No início dos anos 1990, Roger Billings desenvolveu a primeira célula de combustível a hidrogênio para automóveis.[22]
Hidrogênio foi liquefeito pela primeira vez por James Dewar em 1898 ao usar resfriamento regenerativo e sua invenção se aproxima muito daquilo que conhecemos como garrafa térmica nos dias de hoje.[17] Ele produziu hidrogênio sólido no ano seguinte.[17] O deutério foi descoberto em dezembro de 1931 por Harold Urey, e o trítio foi preparado em 1934 por Ernest Rutherford, Marcus Oliphant, e Paul Harteck.[16] A água pesada, que possui deutério no lugar de hidrogênio regular na molécula de água, foi descoberta pela equipe de Urey em 1932.[17]
François Isaac de Rivaz construiu o primeiro dispositivo de combustão interna movido por uma mistura de hidrogênio e oxigênio em 1806. Edward Daniel Clarke inventou o cano de sopro de gás hidrogênio em 1819. A lâmpada de Döbereiner e a Luminária Drummond foram inventadas em 1823.[17]
O enchimento do primeiro balão com gás hidrogênio, foi documentado por Jacques Charles em 1783.[17] O hidrogênio provia a subida para a primeira maneira confiável de viagem aérea seguindo a invenção do primeiro dirigível decolado com hidrogênio em 1852, por Henri Giffard.[17] O conde alemão Ferdinand von Zeppelin promoveu a ideia de usar o hidrogênio em dirigíveis rígidos, que mais tarde foram chamados de Zeppelins; o primeiro dos quais teve seu voo inaugural em 1900.[17] Voos programados regularmente começaram em 1910 e com o surgimento da Primeira Guerra Mundial em agosto de 1914, eles haviam transportado 35 000 passageiros sem qualquer incidente sério. Dirigíveis levantados por hidrogênio foram usados como plataformas de observação e bombardeadores durante a guerra.[23]
O primeiro cruzamento transatlântico sem escalas foi realizado pelo dirigível britânico R34 em 1919. Com o lançamento do Graf Zeppelin nos anos 1920, o serviço regular de passageiros prosseguiu até meados dos anos 1930 sem nenhum acidente. Com a descoberta de reservas de um outro tipo de gás leve nos Estados Unidos, o hélio, esse projeto deveria sofrer modificações, já que o outro elemento prometia um aumento na segurança, mas o governo dos E.U.A. se recusou a vender o gás para este propósito. Sendo assim, H2 foi usado no dirigível Hindenburg, o qual foi destruído em um incidente em pleno voo sobre Nova Jérsia no dia 6 de maio de 1937.[17] O incidente foi transmitido ao vivo no rádio e filmado. A ignição do vazamento de hidrogênio foi atribuída como a causa do incidente, porém, investigações posteriores apontaram à ignição do revestimento de tecido aluminizado pela eletricidade estática.
 |
 |
 |
| Célula de combustível de William Robert Grove (1839).[19] |
Dirigível Hindenburg, 1936 | O desastre do Hindenburg. |
Papel na teoria quântica
[editar | editar código-fonte]
Devido a sua estrutura atômica relativamente simples, consistindo somente de um próton e um elétron, o átomo de hidrogênio, junto com o espectro de luz produzido por ele ou absorvido por ele, foi de suma importância ao desenvolvimento da teoria da estrutura atômica.[24] Além disso, a simplicidade correspondente da molécula de hidrogênio e o cátion correspondente H2+ permitiu um total entendimento da natureza da ligação química, que seguiu pouco depois do tratamento mecânico quântico do átomo de hidrogênio ter sido desenvolvido na metade dos anos 1920.
Um dos primeiros efeitos quânticos a ser explicitamente notado (mas não entendido naquela época) foi a observação de Maxwell envolvendo hidrogênio, meio século antes da teoria da mecânica quântica completa aparecer. Maxwell observou que o calor específico de H2 inexplicavelmente se afasta daquele de um gás diatômico abaixo da temperatura ambiente e começa a parecer gradativamente com aquele de um gás monoatômico em temperaturas criogênicas. Segundo a teoria quântica, este comportamento surge do espaçamento dos níveis de energia rotativos (quantificados), os quais são particularmente bem espaçados em H2 por causa de sua reduzida massa. Estes níveis largamente espaçados inibem partições iguais da energia de calor em movimentos rotativos em hidrogênio sob baixas temperaturas. Gases diatômicos compostos de átomos mais pesados não possuem níveis tão largamente espaçados e não exibem o mesmo efeito.[25]
Ocorrência natural
[editar | editar código-fonte]
Hidrogênio é o elemento mais abundante no universo, compondo 75% da matéria normal por massa e mais de 90% por número de átomos.[26] Este elemento é encontrado em grande abundância em estrelas e planetas gigantes de gás. Nuvens moleculares de H2 são associadas a formação de estrelas. O elemento tem um papel vital em dar energia às estrelas através de cadeias próton-próton e do ciclo CNO de fusão nuclear.[27]
Pelo universo, o hidrogênio é geralmente encontrado nos estados atômico e plasma, cujas propriedades são bem diferentes das do hidrogênio molecular. Como plasma, o elétron e o próton de hidrogênio não estão ligados, resultando em uma condutividade elétrica elevada e alta emissividade (produzindo a luz do Sol). As partículas carregadas são altamente influenciadas por campos elétricos e magnéticos. Por exemplo, no vento solar elas interagem com a magnetosfera da Terra, fazendo surgir as correntes de Birkeland e a aurora. Hidrogênio é encontrado em estado atômico neutro no meio interestelar. Acredita-se que a grande quantidade de hidrogênio neutro encontrado nos sistemas úmidos Lyman-alfa domina a densidade cosmológica bariônica do Universo até o desvio para o vermelho z=4.[28]
Em condições normais de temperatura e pressão na Terra, o hidrogênio existe como um gás diatômico, H2 (para dados ver tabela). Entretanto, o gás de hidrogênio é muito raro na atmosfera da Terra (1 ppm volume) devido à sua pequena densidade, o que o possibilita escapar da gravidade da Terra mais facilmente que gases mais pesados. Entretanto, o hidrogênio (na forma combinada quimicamente) é o terceiro elemento mais abundante na superfície da Terra.[29] A maior parte do hidrogênio da Terra está na forma de compostos químicos tais como hidrocarbonetos e água.[30] O gás de hidrogênio é produzido por algumas bactérias e algas, e é um componente natural do flato. Metano é uma fonte de hidrogênio de crescente importância.[31]
Propriedades
[editar | editar código-fonte]Combustão
[editar | editar código-fonte]
Gás hidrogênio (di-hidrogênio[32]) é altamente inflamável e queima em concentrações de 4% ou mais H2 no ar.[33] A entalpia de combustão para o hidrogênio é −286 kJ/mol;[34] ele queima de acordo com a seguinte equação balanceada.
- 2 H2(g) + O2(g) → 2 H2O(l) + 572 kJ (286 kJ/mol)[35]
Quando misturado com oxigênio por entre uma grande variedade de proporções, o hidrogênio explode por ignição. Hidrogênio queima violentamente no ar, tendo ignição automaticamente na temperatura de 560 °C.[36] Chamas de hidrogênio-oxigênio puros queimam no alcance de cor ultravioleta e são quase invisíveis a olho nu, como ilustrado pela faintness da chama das turbinas principais do ônibus espacial (ao contrário das chamas facilmente visíveis do foguete acelerador sólido). Então ele necessita de um detector de chama para detectar se um vazamento de hidrogênio está queimando.
A explosão do dirigível Hindenburg foi um caso infame de combustão de hidrogênio; a causa é debatida, mas os materiais combustíveis na pele do dirigível foram responsáveis pela coloração das chamas.[37] Outra característica dos fogos de hidrogênio é que as chamas tendem a ascender rapidamente com o gás no ar, como ilustrado pelas chamas do Hindenburg, causando menos dano que fogos de hidrocarboneto. Dois terços dos passageiros do Hindenburg sobreviveram ao incêndio, e muitas das mortes que ocorreram foram da queda ou da queima do combustível diesel.[38]
H2 reage diretamente com outros elementos oxidantes. Uma reação violenta e espontânea pode ocorrer em temperatura ambiente com cloro e flúor, formando os haletos de hidrogênio correspondentes: Cloreto de hidrogênio e fluoreto de hidrogênio.[39]
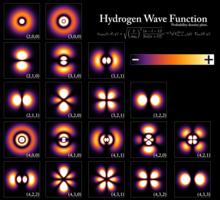
Níveis de energia do elétron
[editar | editar código-fonte]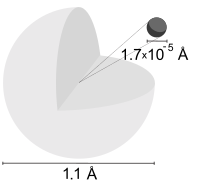

O nível de energia em estado fundamental do elétron de um átomo de hidrogênio é −13,6 eV, o que é equivalente a um fóton ultravioleta de aproximadamente 92 nm.[40]
Os níveis de energia do hidrogênio podem ser calculados razoavelmente com precisão usando o modelo de Bohr para o átomo, o qual conceitualiza o elétron como "orbitando" o próton em analogia à órbita da Terra em relação ao Sol. Entretanto, a força eletromagnética atrai elétrons e prótons para cada um, enquanto planetas e objetos celestiais são atraídos uns aos outros pela gravidade. Por causa da discretização do momento angular postulado por Bohr no começo da mecânica quântica, o elétron no modelo de Bohr pode somente ocupar certas distâncias permitidas do próton, e portanto, somente certas energias permitidas.[41]
Uma descrição mais precisa do átomo de hidrogênio parte de um tratamento puramente mecânico quântico que utiliza a equação de Schrödinger ou a equivalente integração funcional de Feynman para calcular a densidade de probabilidade do elétron perto do próton.[42]
Formas moleculares elementais
[editar | editar código-fonte]
Existem duas moléculas diatômicas diferentes de isômeros spin de hidrogênio que diferem pelo spin relativo de seu núcleo.[43] Na forma de orto-hidrogênio, os spins dos dois prótons são paralelos e formam um estado triplo; na forma de para-hidrogênio, os spins são antiparalelos e formam um singular. Nas condições normais de temperatura e pressão, o gás hidrogênio contém aproximadamente 25% da forma para- e 75% da forma orto-, também conhecido como a "forma normal".[44] A taxa de equilíbrio de orto-hidrogênio para para-hidrogênio depende da temperatura, mas já que a forma orto- é um estado excitado e possui energia mais alta que a forma para-, é instável e não pode ser purificado. Em temperaturas muito baixas, o estado de equilíbrio é composto quase exclusivamente da forma para-. As propriedades físicas do para-hidrogênio puro diferem ligeiramente daquelas da forma normal.[45] A distinção orto-/para- também ocorre em outros grupos funcionais ou moléculas que contêm hidrogênio, como água e metileno.[46]
A interconversão não-catalisada entre para- e orto- H2 aumenta com a temperatura crescente; portanto, H2 rapidamente condensado contém grandes quantidades da forma orto- de alta energia que convertem para a forma para- muito lentamente.[47] A taxa orto-/para- no H2 condensado é uma consideração importante na preparação e armazenagem do hidrogênio líquido: a conversão de orto- para para- é exotérmica e produz calor suficiente para evaporar o hidrogênio líquido, levando a perda do material liquefeito. Catalisadores para a interconversão orto-/para-, como o óxido férrico, carbono ativado, asbesto platinizado, raros metais alcalinos-terrosos, compostos de urânio, óxido crômico, ou compostos de níquel,[48] são usados durante o resfriamento de hidrogênio.[49]
Uma forma molecular chamada hidrogênio protonado molecular, ou H3+, é encontrado no meio interestelar, onde ele é gerado pela ionização do hidrogênio molecular dos raios cósmicos. Também tem sido observado na atmosfera mais alta do planeta Júpiter. Esta molécula é relativamente estável no ambiente do espaço sideral devido a baixa temperatura e densidade. H3+ é um dos íons mais abundantes no Universo, e possui um papel notável na química do meio interestelar.[50]
Compostos
[editar | editar código-fonte]Compostos orgânicos e covalentes
[editar | editar código-fonte]Apesar do hidrogênio, em sua forma gasosa (H2) não reagir muito nas CNTP, em sua forma atômica ele está combinado com a maioria dos elementos da Tabela Periódica, formando compostos com diferentes propriedades químicas e físicas. Ele pode formar compostos com elementos mais eletronegativos, tais como os do grupo 17 da Tabela Periódica (halogênios: (F, Cl, Br, I); nestes compostos, o hidrogênio é marcado por atrair para si uma carga parcial positiva.[51] Quando unido a flúor, oxigênio, ou nitrogênio, o hidrogênio pode participar na forma de forte ligação não-covalente chamada ligação de hidrogênio, que é essencial à estabilidade de muitas moléculas biológicas.[52][53] Hidrogênio também forma compostos com menos elementos eletronegativos, como metais e semimetais, nos quais gera uma carga parcial negativa. Estes compostos são geralmente conhecidos como hidretos.[54]
Quando o hidrogênio se combina com o carbono, ele pode formar uma infinidade de compostos. Devido à marcante presença destes compostos nos organismos vivos, estes vieram a ser chamados de compostos orgânicos e considerados os principais elementos CHONPS (os seis elementos fundamentais para a vida na Terra);[55] o ramo da química que estuda as propriedades destes compostos é conhecido como Química Orgânica[56] e seu estudo no contexto de organismos vivos é conhecido como bioquímica.[57] Por algumas definições, compostos "orgânicos" necessitam apenas da condição de conter carbono. Entretanto, a maior parte destes compostos também contém o hidrogênio e, uma vez que é a ligação carbono-hidrogênio que dá a esta classe de compostos suas características químicas particulares, isso faz com que algumas definições de "Química Orgânica" incluam a presença de ligações químicas entre carbono-hidrogênio.[55]
Na Química Inorgânica, hidretos podem também servir como ligantes de ponte, responsáveis pelo elo entre dois centros metálicos em um composto de coordenação. Esta função é particularmente comum em elementos do grupo 13, especialmente em boranos (hidretos de boro) e complexos de alumínio, assim como em carboranos agrupados.[30]
Na natureza conhece-se milhões de hidrocarbonetos mas eles não são formados pela reação direta do gás hidrogênio com o carbono (apesar da produção de gás de síntese segundo o processo de Fischer-Tropsch para criar hidrocarbonetos ter chegado próxima de ser uma exceção, uma vez que isto inicia-se com carvão e o hidrogênio elementar é gerado no local).
Hidretos
[editar | editar código-fonte]Compostos de hidrogênio são frequentemente chamados de hidretos, um termo que é usado bem livremente. Para químicos, o termo "hidreto" geralmente implica que o átomo H adquiriu um caráter negativo ou aniônico, denotados H−. A existência do ânion hidreto, sugerida por Gilbert N. Lewis em 1916 para hidretos similares ao sal nos grupos I e II, foi demonstrada por Moers em 1920 com a eletrólise de hidreto de lítio (LiH) derretido, que produziu uma quantidade de hidrogênio estequiométrica no ânodo.[58] Para outros hidretos além dos metais de grupo I e II, o termo é bem enganoso, considerando a eletronegatividade de hidrogênio baixa. Uma exceção nos hidretos do grupo II é BeH2, o qual é polimérico. No hidreto de alumínio e lítio, o ânion AlH4− carrega centros hidreticos firmemente ligados ao Al(III). Ainda que hidretos podem ser formados com quase todos os elementos do grupo principal, o número e combinação de possíveis compostos varia vastamente; por exemplo, existem mais de 100 hidretos binários de borano conhecidos, mas somente um hidreto binário de alumínio.[59] Hidreto binário de índio ainda não foi identificado, apesar de complexos mais largos existirem.[60]
Prótons e ácidos
[editar | editar código-fonte]Oxidação de hidrogênio, a fim de remover seu elétron, formalmente gera H+, não contendo elétrons e um núcleo, que é geralmente composto de um próton. É por isso que H+ é frequentemente chamado de próton. Esta espécie é central à discussão de ácidos. Sob a teoria de Brønsted-Lowry, ácidos são doadores de prótons, enquanto bases são receptores de prótons.
Um próton H+ puro não pode existir em solução devido a sua forte tendência de se ligar a átomos ou moléculas com elétrons. Entretanto, o termo 'próton' é usado livremente para se referir ao hidrogênio de carga positiva ou catiônico, denotado H+.
Para evitar a ficção conveniente do "próton em solução" nu, soluções ácidas aquáticas são às vezes consideradas a conter o íon hidrônio (H3O+), que é organizado em grupos para formar H9O4+.[61] Outros íons oxônio são encontrados quando a água está em solução com outros solventes.[62]
Ainda que exóticos na terra, um dos íons mais comuns no universo é o íon H3+, conhecido como hidrogênio protonado molecular ou cátion trihidrogênio.[63]
Isótopos
[editar | editar código-fonte]
O isótopo mais comum do hidrogênio não possui nêutrons, existindo outros dois, o deutério (D) com um e o trítio (T), radioativo com dois. O deutério tem uma abundância natural compreendida entre 0,0184 e 0,0082% (IUPAC). O hidrogênio é o único elemento químico que tem nomes e símbolos químicos distintos para seus diferentes isótopos.
O hidrogénio possuiu ainda outros isótopos altamente instáveis (do 4H ao 7H) e que foram sintetizados em laboratório, mas nunca observados na natureza.[64][65]
- ¹H, conhecido como prótio, é o isótopo mais comum do hidrogénio com uma abundância de mais de 99,98%. Devido a que o núcleo deste isótopo é formado por um só próton ele foi baptizado como prótio, nome que apesar de ser muito descritivo, é pouco usado.
- ²H, o outro isótopo estável do hidrogénio, é conhecido como deutério e o seu núcleo contém um próton e um nêutron. O deutério representa 0,0026% ou 0,0184% (segundo seja em fracção molar ou fracção atómica) do hidrogénio presente na Terra, encontrando-se as menores concentrações no hidrogénio gasoso, e as maiores (0,015% ou 150 ppm) em águas oceânicas. O deutério não é radioactivo, e não representa um risco significativo de toxicidade. A água enriquecida em moléculas que incluem deutério no lugar de hidrogénio ¹H (prótio), denomina-se água pesada. O deutério e seus compostos empregam-se em marcações não radioactivas em experiências e também em dissolventes usados em espectroscopia ¹H - RMN. A água pesada utiliza-se como moderador de nêutrons e refrigerante em reactores nucleares. O deutério é também um potencial combustível para a fusão nuclear com fins comerciais.
- ³H é conhecido como trítio e contém um próton e dois nêutrons no seu núcleo. é radioactivo, desintegrando-se em ³2He+ através de uma emissão beta. Possui uma meia-vida de 12,33 anos.[30] Pequenas quantidades de trítio encontram-se na natureza por efeito da interacção dos raios cósmicos com os gases atmosféricos. Também foi libertado trítio para a realização de provas de armamento nuclear. O trítio usa-se em reações de fusão nuclear, como traçador em Geoquímica Isotópica, e em dispositivos luminosos auto-alimentados. Antes era comum empregar o trítio como radiomarcador em experiências químicas e biológicas, mas actualmente usa-se menos.
O hidrogénio é o único elemento que possui diferentes nomes comuns para cada um de seus isótopos (naturais). Durante o começo dos estudos sobre a radioactividade, a alguns isótopos radioactivos pesados foram-lhes atribuídos nomes, mas nenhum deles se continua a usar). Os símbolos D e T (em lugar de ²H e ³H) usam-se às vezes para referir-se ao deutério e ao trítio, mas o símbolo P corresponde ao fósforo e, portanto, não pode usar-se para representar o prótio. A IUPAC declara que ainda que o uso destes símbolos seja comum, ele não é aconselhado.
Reações biológicas
[editar | editar código-fonte]H2 é um produto de alguns tipos de metabolismo anaeróbico e é produzido por vários microorganismos, geralmente via reações catalisadas por enzimas contendo ferro ou níquel chamadas hidrogenases. Essas enzimas catalisam a reação redox reversível entre H2 e seus componentes, dois prótons e dois elétrons. A criação de gás hidrogênio ocorre na transferência para reduzir equivalentes produzidos durante fermentação do piruvato à água.[66]
A separação da água, na qual a água é decomposta em seus componentes prótons, elétrons, e oxigênio, ocorre na fase clara em todos os organismos fotossintéticos. Alguns organismos — incluindo a alga Chlamydomonas reinhardtii e cianobactéria — evoluíram um passo adiante na fase escura na qual prótons e elétrons são reduzidos para formar gás H2 por hidrogenases especializadas no cloropultimoo.[67] Esforços foram feitos para modificar geneticamente as hidrogenases das cianobactérias para sintetizar o gás H2 eficientemente mesmo na presença de oxigênio.[68] Esforços também foram tomados com algas geneticamente modificadas em um biorreator [69] (ver: Produção biológica de hidrogénio).
Produção
[editar | editar código-fonte]O gás H2 é produzido em laboratórios de química e biologia, muitas vezes como subproduto da desidrogenação de substratos insaturados; e na natureza como meio de expelir equivalentes redutores em reações bioquímicas.
Atualmente plantas industriais produzem aproximadamente 55 milhões de toneladas métricas de hidrogênio,[70] produção representada majoritariamente por 4 (quatro) maneiras: Reforma a vapor do metano, que é basicamente a separação de hidrocarbonetos pelo vapor de água a alta pressão e temperatura com metano e um catalisador geralmente de níquel; reforma de hidrocarbonetos vindos de gases residuais industriais; gasificação do carvão e finalmente eletrólise da água. Outros métodos correspondem a aproximadamente 0,1% da produção de hidrogênio.

Quase metade dessa produção é destinada para a síntese da amônia, componente usado para fertilizantes. A segunda maior fração é por parte das refinarias que utilizam o hidrogênio para remover o enxofre da gasolina e para converter hidrocarbonetos pesados em diesel ou gasolina. Outras indústrias como a metalúrgica, vítrea, farmacêutica e alimentícia consomem o resto da porcentagem de produção.[71]
De acordo com a matéria-prima do qual é produzido, o hidrogênio é classificado por "cores",[72][73] conforme tabela abaixo:[74][71] O "hidrogênio verde" é aquele produzido a partir de fontes de energias renováveis e "limpas".[75]
| Via de produção | Terminologia | Tecnologia | Matéria-prima/fonte de eletricidade | Pegada de gases de efeito estufa |
|---|---|---|---|---|
| Eletricidade | Hidrogênio Verde [75] | Eletrólise | Eólica, Solar, Oceânica, Geotermal, Hidroelétrica | Mínima |
| Hidrogênio Rosa | Nuclear | |||
| Hidrogênio Amarelo | Várias fontes | Média | ||
| Combustíveis Fósseis | Hidrogênio Azul | Reforma de gás natural+Gasificação com captura de carbono (CCS) + CCS | Gás Natural, Carvão | Baixa |
| Hidrogênio Turquesa | Pirólise | Gás natural | Carbono sólido (subproduto) | |
| Hidrogênio Cinza | Reforma de metano | Média | ||
| Hidrogênio Marrom | Gasificação | Lignite ("Carvão Marrom") | Alta | |
| Hidrogênio Negro | Carvão |
Laboratório
[editar | editar código-fonte]No laboratório, o gás H2 é normalmente preparado pela reacção de ácidos com metais tais, como o zinco, por meio do aparelho de Kipp.
Zn + 2 H+ → Zn2+ + H2
O alumínio também pode produzir H2 após tratamento com bases:
2 Al + 6 H2O + 2 OH- → 2 Al(OH)4- + 3 H2
A electrólise da água é um método simples de produzir hidrogénio. Uma corrente elétrica de baixa voltagem corre através da água, e oxigénio gasoso forma-se no ânodo enquanto que hidrogénio gasoso forma-se no cátodo. Tipicamente, o cátodo é feito de platina ou outro metal inerte (geralmente platina ou grafite) quando se produz hidrogénio para armazenamento. Se, contudo, o gás destina-se a ser queimado no local, é desejável haver oxigénio para assistir à combustão, e então ambos os eléctrodos podem ser feitos de metais inertes (eletrodos de ferro devem ser evitados, uma vez que eles consumiriam oxigênio ao sofrerem oxidação). A eficiência máxima teórica (electricidade usada versus valor energético de hidrogénio produzido) está entre 80 e 94%.[76]
Em 2007, descobriu-se que uma liga de alumínio e gálio em forma de pastilhas adicionada a água podia ser usada para gerar hidrogénio. O processo também produz alumina, mas o gálio, que previne a formação de uma película de óxido nas pastilhas, pode ser reutilizado. Isto tem potenciais implicações importantes para a economia baseada no hidrogénio, uma vez que ele pode ser produzido no local e não precisa de ser transportado.[77]
Industrial
[editar | editar código-fonte]O hidrogénio pode ser preparado por meio de vários processos mas, economicamente, o mais importante envolve a remoção de hidrogénio de hidrocarbonetos. Hidrogénio comercial produzido em massa é normalmente produzido pela reformação catalítica de gás natural.[78] A altas temperaturas (700-1 100 °C), vapor de água reage com metano para produzir monóxido de carbono e H2
Esta reacção é favorecida a baixas pressões mas é no entanto conduzida a altas pressões (20 atm) uma vez que H2 a altas pressões é o produto melhor comercializado. A mistura produzida é conhecida como "gás de síntese" porque é muitas vezes usado directamente para a produção de metanol e compostos relacionados. Outros hidrocarbonetos além do metano podem ser usados para produzir gás de síntese com proporção de produtos variáveis. Uma das muitas complicações para esta tecnologia altamente optimizada é a formação de carbono:
CH4 → C + 2 H2
Por consequência, a reformação catalítica faz-se tipicamente com excesso de H2O. Hidrogénio adicional pode ser recuperado do vapor usando monóxido de carbono através da reacção de mudança do vapor de água, especialmente com um catalisador de óxido de ferro. Esta reacção é também uma fonte industrial comum de dióxido de carbono:[78]
Outros métodos importantes para a produção de H2 incluindo oxidação parcial de hidrocarbonetos:[79]
e a reacção de carvão, que pode servir como prelúdio para a "reacção de mudança" descrito acima
Hidrogénio é por vezes produzido e consumido pelo mesmo processo industrial, sem ser separado. No processo de Haber para a produção de amoníaco, é gerado hidrogénio a partir de gás natural.[80] Electrólise de salmoura para produzir cloro também produz hidrogénio como produto secundário.[81]
Termoquímicos solares
[editar | editar código-fonte]Existem mais de 200 ciclos termoquímicos que podem ser utilizados para a separação da água, cerca de uma dúzia de esses ciclos, tais como o ciclo do óxido de ferro, ciclo do óxido cério (III)-óxido cério(IV), ciclo do óxido de zinco-zinco, ciclo do enxofre-iodo, o ciclo do cobre-cloro e ciclo híbrido do enxofre estão sob investigação e em fase de testes para a produção de hidrogênio e oxigênio da água e calor sem o uso da eletricidade.[82] Alguns laboratórios (incluindo França, Alemanha, Grécia, Japão e os EUA) estão a desenvolver métodos termoquímicos para produzir hidrogénio a partir de energia solar e água.[83]
Aplicações
[editar | editar código-fonte]

Grandes quantidades de H2 são necessárias nas indústrias de petróleo e química. A maior aplicação de H2 é para o processamento ("aprimoramento") de combustíveis fósseis, e na produção de amoníaco. Os principais consumidores de H2 em uma fábrica petroquímica incluem hidrodesalquilação, hidrodessulfurização, e hidrocraqueamento. H2 também possui diversos outros usos importantes. H2 é utilizado como um agente hidrogenizante, particularmente no aumento do nível de saturação de gorduras insaturadas e óleos (encontrado em itens como margarina), e na produção de metanol. É semelhantemente a fonte de hidrogênio na manufatura de ácido clorídrico. H2 também é usado como um agente redutor de minérios metálicos.[84]
Além de seu uso como um reagente, o H2 possui amplas aplicações na física e engenharia. É utilizado como um gás de proteção nos métodos de soldagem como soldagem de hidrogênio atômico.[85][86] H2 é usado como cooler de geradores em usinas, por que tem a maior conductividade térmica de qualquer gás. H2 líquido é usado em pesquisas criogênicas, incluindo estudos de supercondutividade.[87] Uma vez que o H2 é mais leve que o ar, tendo um pouco mais do que 1/15 da densidade do ar, foi certa vez vastamente usado como um gás de levantamento em balões e dirigíveis.[88]
Em aplicações mais recentes, o hidrogênio é utilizado puro ou misturado com nitrogênio (às vezes chamado de forming gas) como um gás rastreador para detectar vazamentos. Aplicações podem ser encontradas nas indústrias automotiva, química, de geração de energia, aeroespacial, e de telecomunicações.[89] Hidrogênio é um aditivo alimentar autorizado (E 949) que permite o teste de vazamento de embalagens, entre outras propriedades antioxidantes.[90]
Os isótopos mais raros do hidrogênio também possuem aplicações específicas para cada um. Deutério (hidrogênio-2) é usado em aplicações de fissão nuclear como um moderador para neutrons lentos, e nas reações de fusão nuclear.[17] Compostos de deutério possuem aplicações em química e biologia nos estudos da reação dos efeitos de isótopos.[91] Trítio (hidrogênio-3), produzido em reatores nucleares, é utilizado na produção de bombas de hidrogênio,[92] como um selo isotópico nas ciências biológicas,[93] e como uma fonte de radiação em pinturas luminosas.[94]
A temperatura de equilíbrio do hidrogênio em ponto triplo é um ponto fixo definido na Escala Internacional de Temperaturas de 1990 (ITS-90) a 13,8033 kelvin.[95]
É um possível combustível para uso no transporte, através de queima direta abastecendo motores de combustão interna ou, gerando energia para motores elétricos, através de células de combustível que utilizam o H2 da água. Células de combustível também podem gerar eletricidade do H2 contido no etanol (álcool combustível).[96][97]
Portador de energia
[editar | editar código-fonte]Hidrogênio não é um recurso de energia,[98] exceto no contexto hipotético das usinas comerciais de fusão nuclear usando deutério ou trítio, uma tecnologia atualmente longe de desenvolvimento.[99] A energia do Sol origina-se da fusão nuclear de hidrogênio, mas este processo é difícil de alcançar controlavelmente na Terra.[100] Hidrogênio elementar de fontes solares, biológicas ou elétricas requerem mais energia para criar do que é obtida ao queimá-lo, então, nestes casos, o hidrogênio funciona como um portador de energia, como uma bateria. Ele pode ser obtido de fontes fósseis (como metano), mas estas fontes são insustentáveis.[98]
A densidade de energia por unidade volume de ambos hidrogênio líquido e gás de hidrogênio comprimido em qualquer pressão praticável é significantemente menor do que aquela de fontes tradicionais de combustível, apesar da densidade de energia por unidade massa de combustível é mais alta.[98] Todavia, o hidrogênio elementar tem sido amplamente discutido no contexto da energia, como um possível portador de energia futuro em uma grande escala da economia.[101] Por exemplo, CO2 sequestramento seguido de captura e armazenamento de carbono poderia ser conduzido ao ponto da produção de H2 a partir de combustíveis fósseis.[102] O hidrogênio usado no transporte queimaria relativamente limpo, com algumas emissões de NOx,[103] porém sem emissões de carbono.[102] Entretanto, os custos de infraestrutura associados com a conversão total a uma economia de hidrogênio seria substancial.[104]
Indústria de semicondutores
[editar | editar código-fonte]Hidrogênio é empregado para saturar ligações quebradas de silício amorfo e carbono amorfo que ajudam a estabilizar propriedades materiais.[105] É também um potencial doador de elétron em vários materiais óxidos, incluindo ZnO,[106][107] SnO2, CdO, MgO,[108] ZrO2, HfO2, La2O3, Y2O3, TiO2, SrTiO3, LaAlO3, SiO2, Al2O3, ZrSiO4, HfSiO4, e SrZrO3.[109]
Segurança e precauções
[editar | editar código-fonte]
O hidrogênio gera vários perigos à segurança humana, de potenciais detonações e incêndios quando misturado com o ar a ser um asfixiante em sua forma pura, livre de oxigênio.[110] Em adição, hidrogênio líquido é um criogênico e apresenta perigos (como congelamento) associados a líquidos muito gelados.[111] O elemento dissolve-se em alguns metais, e, além de vazar, pode ter efeitos adversos neles, como a fragilização por hidrogênio.[112] O vazamento de gás hidrogênio no ar externo pode espontaneamente entrar em combustão. Além disso, o fogo de hidrogênio, enquanto sendo extremamente quente, é quase invisível, e portanto pode levar a queimaduras acidentais.[113]
Até mesmo interpretar os dados do hidrogênio (incluindo dados para a segurança) é confundido por diversos fenômenos. Muitas propriedades físicas e químicas do hidrogênio dependem da taxa de para-hidrogênio/orto-hidrogênio (geralmente levam-se dias ou semanas em uma dada temperatura para alcançar a taxa de equilíbrio, pelo qual os resultados usualmente aparecem. os parâmetros de detonação do hidrogênio, como a pressão e temperatura críticas de fundição, dependem muito da geometria do contentor.[110]
Ver também
[editar | editar código-fonte]Nota
[editar | editar código-fonte]- ↑ No entanto, a maior parte da massa do universo não está na forma de bariones ou elementos químicos. Veja-se matéria escura e energia escura.
Referências
- ↑ «hidrogénio». Consultado em 25 de novembro de 2013
- ↑ Cabral Murphy (2009). «Hidrogênio é o Futuro». Revista Galileu
- ↑ «Hydrogen - humans, body, used, water, process, Earth, chemical, energy». Science Clarified (em inglês). Advameg. Consultado em 23 de abril de 2018
- ↑ Palmer, David (13 de setembro de 1997). «Hydrogen in the Universe». NASA. Consultado em 1 de dezembro de 2008
- ↑ Staff (2007). «Hydrogen Basics — Production». Florida Solar Energy Center. Consultado em 1 de dezembro de 2008
- ↑ Gurov YB, Aleshkin DV, Berh MN, Lapushkin SV, Morokhov PV, Pechkurov VA, Poroshin NO, Sandukovsky VG, Tel'kushev MV, Chernyshev BA, Tschurenkova TD. (2004). Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei. Physics of Atomic Nuclei 68(3):491-497.
- ↑ Korsheninnikov AA. et al. (2003). Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He. Phys Rev Lett 90, 082501.
- ↑ Rogers, H. C. (1999). «Hydrogen Embrittlement of Metals». Science. 159 (3819): 1057–1064. ISSN 0036-8075. PMID 17775040. doi:10.1126/science.159.3819.1057
- ↑ Christensen, C. H.; Nørskov, J. K.; Johannessen, T. (9 de Julho de 2005). «Making society independent of fossil fuels — Danish researchers reveal new technology». Technical University of Denmark. Consultado em 1 de dezembro de 2008
- ↑ Takeshita, T.; Wallace, W.E.; Craig, R.S. (1974). «Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt». Inorganic Chemistry. 13 (9): 2282–2283. doi:10.1021/ic50139a050
- ↑ Kirchheim, R.; Mutschele, T.; Kieninger, W (1988). «Hydrogen in amorphous and nanocrystalline metals». Materials Science and Engineering. 99: 457–462. doi:10.1016/0025-5416(88)90377-1
- ↑ Kirchheim, R. (1988). «Hydrogen solubility and diffusivity in defective and amorphous metals». Progress in Materials Science. 32 (4): 262–325. doi:10.1016/0079-6425(88)90010-2
- ↑ a b Alpher, R. A.; Bethe, H.; Gamow, G. (1 de abril de 1948). «The Origin of Chemical Elements». Physical Review. 73 (7): 803–804. Bibcode:1948PhRv...73..803A. doi:10.1103/PhysRev.73.803
- ↑ Andrews, A. C. (1968). «Oxygen». In: Clifford A. Hampel. The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. p. 272. LCCN 68-29938
- ↑ Mark, Winter (2007). «Hydrogen: historical information». WebElements Ltd. Consultado em 4 de dezembro de 2008
- ↑ a b «Hydrogen». Van Nostrand's Encyclopedia of Chemistry. Wylie-Interscience. 2005. p. 797–799. ISBN 0-471-61525-0
- ↑ a b c d e f g h i j k Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. p. 183–191. ISBN 0-19-850341-5
- ↑ Stwertka, Albert (1996). A Guide to the Elements. [S.l.]: Oxford University Press. p. 16–21. ISBN 0-19-508083-1
- ↑ a b «Mr. W. R. Grove on a new Voltaic Combination». The London and Edinburgh Philosophical Magazine and Journal of Science (em inglês). 1838. Consultado em 2 de julho de 2023
- ↑ Grove, William Robert (1839). «On Voltaic Series and the Combination of Gases by Platinum». Philosophical Magazine and Journal of Science (em inglês). XIV (86–87): 127–130. doi:10.1080/14786443908649684 Consultado em 2 de julho de 2023
- ↑ «The Brits who bolstered the Moon landings». BBC (em inglês). Consultado em 2 de julho de 2023
- ↑ «Spotlight on Dr. Roger Billings». Computer Technology Review. Consultado em 2 de julho de 2023
- ↑ Lehmann, Ernst A.; Mingos, Howard (1927). «1: German airships prepare for war». The Zeppelins: The Development of the Airship, with the Story of the Zepplins Air Raids in the World War. [S.l.: s.n.]
- ↑ Crepeau, Bob (1 de janeiro de 2006). «Niels Bohr: The Atomic Model». Great Scientific Minds. Great Neck Publishing. ISBN 1-4298-0723-7. Consultado em 9 de dezembro de 2008
- ↑ Berman, R.; Cooke, A. H.; Hill, R. W. (1956). «Cryogenics». Annual Review of Physical Chemistry. 7. p. 1–20. doi:10.1146/annurev.pc.07.100156.000245
- ↑ Gagnon, Steve. «Hydrogen». Jefferson Lab. Consultado em 3 de dezembro de 2008
- ↑ Haubold, Hans; Mathai, A. M. (15 de novembro de 2007). «Solar Thermonuclear Energy Generation». Columbia University. Consultado em 3 de dezembro de 2008. Arquivado do original em 10 de março de 2006
- ↑ Storrie-Lombardi, Lisa J.; Wolfe, Arthur M. (2000). «Surveys for z > 3 Damped Lyman-alpha Absorption Systems: the Evolution of Neutral Gas». Astrophysical Journal. 543. p. 552–576. doi:10.1086/317138. Consultado em 4 de dezembro de 2008
- ↑ Dresselhaus, Mildred; et al. (15 de maio de 2003). «Basic Research Needs for the Hydrogen Economy» (PDF). Argonne National Laboratory, U.S. Department of Energy, Office of Science Laboratory. Consultado em 4 de dezembro de 2008. Arquivado do original (PDF) em 13 de fevereiro de 2008
- ↑ a b c Miessler, Gary L.; Tarr, Donald A. (2003). Inorganic Chemistry 3rd edition ed. [S.l.]: Prentice Hall. ISBN 0130354716
- ↑ Berger, Wolfgang H. (15 de novembro de 2007). «The Future of Methane». University of California, San Diego. Consultado em 4 de dezembro de 2008
- ↑ «University of Southern Maine-Dihydrogen». Consultado em 15 de dezembro de 2008. Arquivado do original em 13 de fevereiro de 2009
- ↑ Carcassi, M. N.; Fineschi, F. (Junho de 2005). «Deflagrations of H2–air and CH4–air lean mixtures in a vented multi-compartment environment». Energy. 30 (8). p. 1439–1451. doi:10.1016/j.energy.2004.02.012
- ↑ National Academy of Engineering, National Academy of Sciences (2004). The Hydrogen Economy: Opportunities, Costs,. [S.l.]: National Academies Press. p. 240. ISBN 0309091632
- ↑ Energia é por mol de material combustível, Hidrogênio. 286 kJ/mol
- ↑ Staff (10 de outubro de 2005). «Safety data for hydrogen». Chemical and Other Safety Information. The Physical and Theoretical Chemistry Laboratory, Oxford University. Consultado em 15 de dezembro de 2008
- ↑ Dziadecki, John (2005). «Hindenburg Hydrogen Fire». Consultado em 15 de dezembro de 2008
- ↑ Werthmüller, Andreas. «The Hindenburg Disaster». Swiss Hydrogen Association. Consultado em 15 de dezembro de 2008. Arquivado do original em 10 de fevereiro de 2008
- ↑ Clayton, Donald D. (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. [S.l.]: Cambridge University Press. ISBN 0521823811
- ↑ Millar, Tom (10 de dezembro de 2003). «Lecture 7, Emission Lines — Examples». PH-3009 (P507/P706/M324) Interstellar Physics. University of Manchester. Consultado em 5 de fevereiro de 2008. Arquivado do original em 16 de novembro de 2011
- ↑ Stern, David P. (16 de maio de 2005). «The Atomic Nucleus and Bohr's Early Model of the Atom». NASA Goddard Space Flight Center. Consultado em 12 de dezembro de 2008
- ↑ Stern, David P. (13 de fevereiro de 2005). «Wave Mechanics». NASA Goddard Space Flight Center. Consultado em 12 de dezembro de 2008
- ↑ Staff (2003). «Hydrogen (H2) Properties, Uses, Applications: Hydrogen Gas and Liquid Hydrogen». Universal Industrial Gases, Inc. Consultado em 15 de dezembro de 2008
- ↑ Tikhonov, Vladimir I.; Volkov, Alexander A. (2002). «Separation of Water into Its Orto and Para Isomers». Science. 296 (5577). p. 2363. PMID 12089435. doi:10.1126/science.1069513
- ↑ Hritz, James (março de 2006). «CH. 6 - Hydrogen» (PDF). NASA Glenn Research Center Glenn Safety Manual, Document GRC-MQSA.001. NASA. Consultado em 15 de dezembro de 2008
- ↑ Shinitzky, Meir; Elitzur, Avshalom C. (30 de maio de 2006). «Ortho-para spin isomers of the protons in the methylene group». Chirality. 18 (9). Rehovot, Israel: Weizmann Institute of Science. p. 754–756. doi:10.1002/chir.20319. Consultado em 15 de dezembro de 2008
- ↑ Milenko, Yu. Ya.; Sibileva, R. M.; Strzhemechny, M. A (1997). «Natural ortho-para conversion rate in liquid and gaseous hydrogen». Journal of Low Temperature Physics. 107 (1–2). p. 77–92. doi:10.1007/BF02396837
- ↑ «Ortho-Para conversion. Pag. 13» (PDF). Consultado em 15 de dezembro de 2008. Arquivado do original (PDF) em 16 de dezembro de 2008
- ↑ Svadlenak, R. Eldo; Scott, Allen B (1957). «The Conversion of Ortho- to Parahydrogen on Iron Oxide-Zinc Oxide Catalysts». Journal of the American Chemical Society. 79 (20). p. 5385–5388. doi:10.1021/ja01577a013
- ↑ McCall Group, Oka Group (22 de abril de 2005). «H3+ Resource Center». Universities of Illinois and Chicago. Consultado em 15 de dezembro de 2008
- ↑ Clark, Jim (2002). «The Acidity of the Hydrogen Halides». Chemguide. Consultado em 19 de dezembro de 2008
- ↑ Kimball, John W. (7 de agosto de 2003). «Hydrogen». Kimball's Biology Pages. Consultado em 19 de dezembro de 2008
- ↑ IUPAC Compendium of Chemical Terminology, Electronic version, Hydrogen Bond
- ↑ Sandrock, Gary (2 de maio de 2002). «Metal-Hydrogen Systems». Sandia National Laboratories. Consultado em 19 de dezembro de 2008. Arquivado do original em 24 de fevereiro de 2008
- ↑ a b «Structure and Nomenclature of Hydrocarbons». Purdue University. Consultado em 19 de dezembro de 2008
- ↑ «Organic Chemistry». Dictionary.com. Lexico Publishing Group. 2008. Consultado em 19 de dezembro de 2008
- ↑ «Biochemistry». Dictionary.com. Lexico Publishing Group. 2008. Consultado em 19 de dezembro de 2008
- ↑ Moers, Kurt (1920). «Investigations on the Salt Character of Lithium Hydride». Zeitschrift für Anorganische und Allgemeine Chemie. 113 (191). p. 179–228. doi:10.1002/zaac.19201130116
- ↑ Downs, Anthony J.; Pulham, Colin R. (1994). «The hydrides of aluminium, gallium, indium, and thallium: a re-evaluation». Chemical Society Reviews. 23. p. 175–184. doi:10.1039/CS9942300175
- ↑ Hibbs, David E.; Jones, Cameron; Smithies, Neil A. (1999). «A remarkably stable indium trihydride complex: synthesis and characterisation of [InH3P(C6H11)3]». Chemical Communications. p. 185–186. doi:10.1039/a809279f
- ↑ Okumura, Anthony M.; Yeh, L. I.; Myers, J. D.; Lee, Y. T (1990). «Infrared spectra of the solvated hydronium ion: vibrational predissociation spectroscopy of mass-selected 3O+•(H2O)n•(H2)m». Journal of Physical Chemistry. 94 (9). p. 3416–3427. doi:10.1021/j100372a014
- ↑ Perdoncin, Giulio; Scorrano, Gianfranco (1977). «Protonation Equilibria in Water at Several Temperatures of Alcohols, Ethers, Acetone, Dimethyl Sulfide, and Dimethyl Sulfoxide». Journal of the American Chemical Society. 99 (21). p. 6983–6986. doi:10.1021/ja00463a035
- ↑ Carrington, Alan; R. McNab, Iain (1989). «The infrared predissociation spectrum of triatomic hydrogen cation (H3+)». Accounts of Chemical Research. 22 (6). p. 218–222. doi:10.1021/ar00162a004
- ↑ Gurov YB, Aleshkin DV, Berh MN, Lapushkin SV, Morokhov PV, Pechkurov VA, Poroshin NO, Sandukovsky VG, Tel'kushev MV, Chernyshev BA, Tschurenkova TD. (2004). Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei. Physics of Atomic Nuclei 68(3):491–497.
- ↑ Korsheninnikov AA. et al. (2003). Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He. Phys Rev Lett 90, 082501.
- ↑ Cammack, Richard; Robson, R. L. (2001). Hydrogen as a Fuel: Learning from Nature. [S.l.]: Taylor & Francis Ltd. ISBN 0415242428
- ↑ Kruse, O.; Rupprecht, J.; Bader, K.-P.; Thomas-Hall, S.; Schenk, P. M.; Finazzi, G.; Hankamer, B (2005). «Improved photobiological H2 production in engineered green algal cells». The Journal of Biological Chemistry. 280 (40). p. 34170–7. PMID 16100118. doi:10.1074/jbc.M503840200
- ↑ Smith, H. O.; Xu, Q (2005). «IV.E.6 Hydrogen from Water in a Novel Recombinant Oxygen-Tolerant Cyanobacteria System» (PDF). FY2005 Progress Report. United States Department of Energy. Consultado em 28 de novembro de 2008
- ↑ Williams, Chris (24 de fevereiro de 2006). «Pond life: the future of energy». Science. The Register. Consultado em 28 de novembro de 2008
- ↑ Navarro, R.M.; Guil, R.; Fierro, J.L.G. (2015). «Introduction to hydrogen production». Elsevier: 21–61. ISBN 978-1-78242-361-4. doi:10.1016/b978-1-78242-361-4.00002-9. Consultado em 8 de julho de 2024
- ↑ a b Kniss, D. Notas sobre a transição da economia carbonífera hodierna a uma economia do hidrogênio e aspectos econômicos para a geração de políticas públicas mission-based. In: Rita de Cássia Marques Lima de Castro; Maria Cristina Cacciamali; Júlio César Suzuki. (Org.). O dito e o interdito do desenvolvimento socioeconômico. 1ed. São Paulo: FFLCH/USP, PROLAM/USP, 2023, v. , p. 73-100. Disponível em: <https://www.livrosabertos.abcd.usp.br/portaldelivrosUSP/catalog/book/1112>
- ↑ «Hydrogen – data telling a story». Global Energy Infrastructure (em inglês). 30 de março de 2021. Consultado em 3 de outubro de 2022
- ↑ Rozich, Alan (29 de novembro de 2021). «"Green" Hydrogen Should Play by the Same Rules as Renewable Natural Gas (RNG)». Energy Central (em inglês). Consultado em 3 de outubro de 2022
- ↑ WEC –World Energy Council. Hydrogen on the horizon: Ready, Almost set, go?: Working Paper | Nation Hydrogen Strategies. 2021. 20 p. Disponível em: <https://www.worldenergy.org/assets/downloads/Innovation_Insights_Briefing_-_Hydrogen_on_the_Horizon_-_Ready%2C_Almost_Set%2C_Go_-_July_2021.pdf>
- ↑ a b IFSC VERIFICA (29 agosto de 2023). «Já ouviu falar no hidrogênio verde? Saiba o que é e como ele pode ajudar no combate às mudanças climáticas». ifsc.edu.br/. Instituto Federal de Santa Catarina. Consultado em 2 de outubro de 2024
- ↑ Kruse, B.; Grinna, S.; Buch, C. (2002). «Hydrogen Status og Muligheter» (PDF). Bellona. Consultado em 12 de fevereiro de 2008. Arquivado do original (PDF) em 16 de fevereiro de 2008
- ↑ Venere, Emil (15 de maio de 2007). «New process generates hydrogen from aluminum alloy to run engines, fuel cells». Purdue University. Consultado em 5 de fevereiro de 2008
- ↑ a b c Oxtoby, D. W. (2002). Principles of Modern Chemistry 5th edition ed. [S.l.]: Thomson Brooks/Cole. ISBN 0030353734
- ↑ «Hydrogen Properties, Uses, Applications». Universal Industrial Gases, Inc. 2007. Consultado em 11 de março de 2008
- ↑ Funderburg, Eddie (2008). «Why Are Nitrogen Prices So High?». The Samuel Roberts Noble Foundation. Consultado em 11 de março de 2008. Arquivado do original em 9 de maio de 2001
- ↑ Lees, Andrew (2007). «Chemicals from salt». BBC. Consultado em 11 de março de 2008
- ↑ Perret, Robert. «Development of Solar-Powered Thermochemical Production of Hydrogen from Water, DOE Hydrogen Program, 2007» (PDF). Consultado em 17 de Maio de 2008
- ↑ Robert Perret. «Development of Solar-Powered Thermochemical Production of Hydrogen from Water, DOE Hydrogen Program, 2007» (PDF). Consultado em 17 de maio de 2008
- ↑ Chemistry Operations (15 de dezembro de 2003). «Hydrogen». Los Alamos National Laboratory. Consultado em 12 de dezembro de 2008
- ↑ Durgutlu, Ahmet (27 de outubro de 2003). «Experimental investigation of the effect of hydrogen in argon as a shielding gas on TIG welding of austenitic stainless steel». ScienceDirect. 25 (1). Ankara, Turkey: Gazi University. p. 19–23. doi:10.1016/j.matdes.2003.07.004. Consultado em 12 de dezembro de 2008
- ↑ «Atomic Hydrogen Welding». Specialty Welds. 2007. Consultado em 12 de dezembro de 2008. Arquivado do original em 16 de julho de 2011
- ↑ Hardy, Walter N. (19 de março de 2003). «From H2 to cryogenic H masers to HiTc superconductors: An unlikely but rewarding path». Physica C: Superconductivity. 388–389. Vancouver, Canada: University of British Columbia. p. 1–6. doi:10.1016/S0921-4534(02)02591-1. Consultado em 12 de dezembro de 2008
- ↑ Barnes, Matthew (2004). «LZ-129, Hindenburg». The Great Zeppelins. Consultado em 12 de dezembro de 2008
- ↑ Block, Matthias (3 de setembro de 2004). «Hydrogen as Tracer Gas for Leak Detection». 16th WCNDT 2004. Montreal, Canada: Sensistor Technologies. Consultado em 12 de dezembro de 2008
- ↑ «Report from the Commission on Dietary Food Additive Intake» (PDF). European Union. Consultado em 12 de dezembro de 2008
- ↑ Reinsch, J; A Katz, J Wean, G Aprahamian, JT MacFarland (Outubro de 1980). «The deuterium isotope effect upon the reaction of fatty acyl-CoA dehydrogenase and butyryl-CoA». J. Biol. Chem. 255 (19). p. 9093–97. PMID 7410413. Consultado em 14 de dezembro de 2008
- ↑ Bergeron, Kenneth D. (janeiro–fevereiro de 2004). «The Death of no-dual-use». Bulletin of the Atomic Scientists. 60 (1). Educational Foundation for Nuclear Science, Inc. p. 15. doi:10.2968/060001004. Consultado em 14 de dezembro de 2008
- ↑ Holte, Aurali E.; Houck, Marilyn A.; Collie, Nathan L. (3 de novembro de 2004). «Potential Role of Parasitism in the Evolution of Mutualism in Astigmatid Mites». Experimental and Applied Acarology. 25 (2). Lubbock: Texas Tech University. p. 97–107. doi:10.1023/A:1010655610575
- ↑ Quigg, Catherine T. (Março de 1984). «Tritium Warning». Bulletin of the Atomic Scientists. 40 (3). Chicago. p. 56–57. ISSN 0096-3402
- ↑ «International Temperature Scale of 1990» (PDF). Procès-Verbaux du Comité International des Poids et Mesures. 1989. p. T23–T42. Consultado em 15 de dezembro de 2008
- ↑ Garcia, Rafael H.L. (15 de junho de 2021). «IPEN/CNEN e Nissan renovam parceria para lançar célula a combustível a etanol no Brasil». IPEN. Consultado em 2 de julho de 2023
- ↑ Palazi, Ana Paula (29 de julho de 2022). «Carro elétrico movido a etanol». Jornal da UNICAMP. Consultado em 2 de julho de 2023
- ↑ a b c McCarthy, John (31 de dezembro de 1995). «Hydrogen». Stanford University. Consultado em 15 de dezembro de 2008. Arquivado do original em 14 de março de 2008
- ↑ «Nuclear Fusion Power». World Nuclear Association. Maio de 2007. Consultado em 15 de dezembro de 2008
- ↑ «Chapter 13: Nuclear Energy — Fission and Fusion». Energy Story. California Energy Commission. 2006. Consultado em 15 de dezembro de 2008. Arquivado do original em 2 de março de 2008
- ↑ «DOE Seeks Applicants for Solicitation on the Employment Effects of a Transition to a Hydrogen Economy». Hydrogen Program. US Department of Energy. 22 de março de 2006. Consultado em 15 de dezembro de 2008
- ↑ a b «Carbon Capture Strategy Could Lead to Emission-Free Cars». Georgia Tech. 11 de fevereiro de 2008. Consultado em 15 de dezembro de 2008
- ↑ Heffel, James W. (24 de dezembro de 2002). «NOx emission and performance data for a hydrogen fueled internal combustion engine at 1500 rpm using exhaust gas recirculation». International Journal of Hydrogen Energy. 28 (8). Riverside, CA: University of California. p. 901–908. doi:10.1016/S0360-3199(02)00157-X. Consultado em 15 de dezembro de 2008
- ↑ Ver Romm, Joseph J. (2004). The Hype About Hydrogen: Fact And Fiction In The Race To Save The Climate 1st edition ed. [S.l.]: Island Press. ISBN 155963703X
- ↑ Le Comber, P. G.; Jones, D. I. e Spear, W. E. (1977). «Hall effect and impurity conduction in substitutionally doped amorphous silicon». Philosophical Magazine (em inglês). 35 (5). pp. 1173–1187
- ↑ Van de Walle, Chris G. (2000). «Hydrogen as a cause of doping in zinc oxide». Physical Review Letters (em inglês). 85 (5). pp. 1012–1015
- ↑ Janotti, Anderson; Van de Walle, Chris G. (2007). «Hydrogen multicentre bonds». Nature Materials (em inglês). 6. pp. 44–47
- ↑ Kilic, Cetin; Zunger, Alex (2002). «n-type doping of oxides by hydrogen». Applied Physics Letters (em inglês). 81 (1). pp. 73–75
- ↑ Peaconck, P. W.; Robertson, J. (2003). «Behavior of hydrogen in high dielectric constant oxide gate insulators». Applied Physics Letters (em inglês). 83 (10). pp. 2025–2027
- ↑ a b Brown, W. J.; et al. (1997). «Safety Standard for Hydrogen and Hydrogen Systems» (PDF). NASA
- ↑ «Liquid Hydrogen MSDS» (PDF). Praxair, Inc. Setembro de 2004. Consultado em 1 de dezembro de 2008. Arquivado do original (PDF) em 27 de maio de 2008
- ↑ «'Bugs' and hydrogen embrittlement». Science News. 128 (3). Washington D.C. 20 de julho de 1985. p. 41. ISSN 0036-8423. doi:10.2307/3970088
- ↑ «Hydrogen Safety». Humboldt State University. Consultado em 1 de dezembro de 2008. Arquivado do original em 17 de fevereiro de 2008
Bibliografia
[editar | editar código-fonte]- «Chart of the Nuclides». General Electric Company. Fourteenth Edition. 1989
- Ferreira-Aparicio, P; M. J. Benito, J. L. Sanz (2005). «New Trends in Reforming Technologies: from Hydrogen Industrial Plants to Multifuel Microreformers». Catalysis Reviews. 47. p. 491–588. doi:10.1080/01614940500364958
- Newton, David E. (1994). The Chemical Elements. New York, NY: Franklin Watts. ISBN 0-531-12501-7
- Rigden, John S. (2002). Hydrogen: The Essential Element. Cambridge, MA: Harvard University Press. ISBN 0-531-12501-7
- Romm, Joseph, J. (2004). The Hype about Hydrogen, Fact and Fiction in the Race to Save the Climate. [S.l.]: Island Press. ISBN 1-55963-703-X Author interview at Global Public Media.
- Stwertka, Albert (2002). A Guide to the Elements. New York, NY: Oxford University Press. ISBN 0-19-515027-9
Ligações externas
[editar | editar código-fonte]- «WebElements.com» (em inglês)
- «EnvironmentalChemistry.com» (em inglês)
- «It's Elemental» (em inglês)
- «Modelo do átomo de hidrogênio em escala» (em inglês)
- «Informações sobre Hidrogênio»




