Marcador isotópico
Marcador isotópico ou marcação isotópica é uma técnica para rastrear a passagem de uma amostra de substância, um isótopo (um átomo com uma variação detectável no número de nêutrons) através de um sistema (uma reação química, uma via metabólica, ou uma célula). Se estes isótopos não usuais são detectados posteriormente em certa parte do sistema, deveriam originar-se da substância marcada. A substância, um reagente, é 'marcada' ao incluir isótopos pouco usuais em sua composição química, substituindo átomos específicos por seu isótopo. É permitido então ao reagente a sofrer a reação. A posição dos isótopos nos produtos é medida para determinar a sequência que o átomo isotópico seguiu na reação ou a via metabólica da célula. Os nuclídeos usado na marcação isotópica podem ser nuclídeos estáveis ou radionuclídeos. Neste último caso, a marcação é chamada radiomarcação.[1]
Na marcação isotópica comum, existem múltiplas formas de detectar a presença de isótopos de marcação, através de suas diferentes massas, modos vibracionais ou decaimento radioativo. Espectrometria de massa detecta as diferenças na massa de isótopos, enquanto espectroscopia de infravermelho detecta a diferença nos modos vibracionais dos isótopos. Ressonância magnética nuclear detecta átomos com diferentes razões giromagnéticas. O decaimento radioativo pode ser detectado através de uma câmara de ionização ou autorradiografias de géis.[2][3][4][5]
Um exemplo do uso do marcador isotópico é o estudo do fenol (C6H5OH) em água, ao substituir-se hidrogênio (prótio) com deutério (marcado com deutério). Ao acrescentar-se fenol à água deuterada (água que contém D2O além do H2O usual), se observa a substituição de deutério por o hidrogênio no grupo hidroxilo do fenol (resultando em C6H5OD), indicando que o fenol sofre rapidamente reações de intercâmbio de hidrogênio com a água. Somente o grupo hidroxilo é afetado, indicando que os outros 5 átomos de hidrogênio não participam nestas reações de intercâmbio. Para efeitos experimentais e didáticos em laborratório, o resorcinol é deuterado muito mais rapidamente em condições ácidas do que o fenol, mantendo um efeito isotópico comparável.[6]
Marcador isotópico
[editar | editar código-fonte]
Um marcador isotópico, ou traçador isotópico, é usado em química e bioquímica para ajudar a entender reações química e interações. Nesta técnica, um ou mais dos átomos das molécula de interesse é substituído por um átomo do mesmo elemento químico, mas de um diferente isótopo (como um isótopo radiativo usado em marcação radioativa). Como o átomo marcado possui o mesmo número de prótons, ele se comportará quase exatamente da mesma forma que seu equivalente não marcado e, com poucas exceções, não interferirá na reação sob investigação. A diferença no número de nêutrons, no entanto, significa que ele pode ser detectado separadamente dos outros átomos do mesmo elemento.
Ressonância magnética nuclear (RMN) e espectrometria de massa (MS) são usados para investigar os mecanismos de reações químicas. RMN e SM detecta diferenças isotópicas, que permite determinar informações sobre a posição dos átomos rotulados na estrutura dos produtos. Com informações sobre o posicionamento dos átomos isotópicos nos produtos, a via de reação utilizada pelos metabólitos iniciais para converter os produtos pode ser determinada. Isótopos radioativos podem ser testados usando as autorradiografias de géis na eletroforese em gel. A radiação emitida por compostos contendo os isótopos radioativos escurece um pedaço de filme fotográfico, registrando a posição dos compostos marcados em relação aos outros no gel.
Os marcadores isotópicos são comumente usados na forma de razões isotópicas. Ao estudar a razão entre dois isótopos do mesmo elemento, evitamos efeitos que envolvam a abundância geral do elemento, que geralmente inunda as variações muito menores nas abundâncias isotópicas. Os marcadores isotópicos são algumas das ferramentas mais importantes na geologia porque eles podem ser usados para entender processos complexos de mistura em sistemas terrestres. Uma discussão mais aprofundada sobre a aplicação de marcadores isotópicos em geologia é abordada sob o título de geoquímica isotópica.
Os marcadores isotópicos são geralmente subdivididos em duas categorias: marcadores de isótopos estáveis e marcadores isotópicos radiogênicos. Marcadores isotópicos estáveis envolvem apenas isótopos não radiogênicos e geralmente dependem da massa. Em teoria, qualquer elemento com dois isótopos estáveis pode ser usado como um marcador isotópico. No entanto, os marcadores isotópicos estáveis mais comumente usados envolvem isótopos relativamente leves, que sofrem fracionamento prontamente em sistemas naturais, o que possibilita a determinação de uma assinatura isotópica destes elementos. Um rastreador isotópico radiogênico envolve um isótopo produzido por decaimento radioativo, que geralmente está em uma proporção com um isótopo não radiogênico (cuja abundância na terra não varia devido a decaimento radioativo).[8]
Marcação por isótopos estáveis
[editar | editar código-fonte]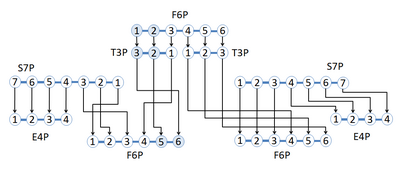
A marcação por isótopos estáveis envolve o uso de isótopos não radioativas que podem atuar como marcadores usados para modelar vários sistemas químicos e bioquímicos. O isótopo escolhido pode atuar como um marcador nesse composto que pode ser identificado através de ressonância magnética nuclear (RMN) e espectrometria de massa (MS). Alguns dos isótopos estáveis mais comuns são 2H, 13C e 15N, que podem ainda ser produzidos em solventes para RMN, aminoácidos, ácidos nucleicos, lipídios, metabólitos comuns e meios de crescimento celular.[10] Os compostos produzidos usando isótopos estáveis são especificados pela porcentagem de isótopos marcados (i.e., glucose 30% uniformemente marcados em 13C contém uma mistura que é 30% marcada com isótopo de carbono 13 e 70% de carbono naturalmente marcado) ou por posições de carbono especificamente marcadas no composto (i.e. glucose 1-13C é marcada no carbono na primeira posição da glucose).
Uma rede de reações adotada da via da glicólise e a via das pentoses-fosfato é mostrada no qual o isótopo de carbono marcado se rearranja para diferentes posições de carbono em toda a rede de reações. A rede começa com frutose-6-fosfato (F6P), a qual tem 6 átomos de carbono com um marcador 13C no carbono de posição 1 e 2. 1,2-13C F6P torna-se dois gliceraldeído-3-fosfato (G3P), um 2,3-13C T3P e um T3P não marcado. O 2,3-13C T3P pode agora ser reagido com sedoeptulose-7-fosfato (S7P) para formar um eritrose-4-fosfato (E4P) não marcado de um 5,6-13C F6P. O T3P não marcado irá reagir com o S7P para sintetizar produtos não marcados.[9] A figura demonstra o uso de marcação isotópica estável para descobrir o rearranjo de átomos de carbono através de reações usando compostos marcados com posição específica.
Análise de fluxo metabólico usando marcação isotópica estável
[editar | editar código-fonte]
Análise de fluxo metabólico (AFM, na literatura em inglês abreviada como MFA, de metabolic flux analysis) usando marcação por isótopo estável é uma ferramenta importante para explicando o fluxo de certos elementos através das vias metabólicas e reações dentro de uma célula. Um marcador isotópico é alimentado para a célula e, em seguida, é permitido que a célula cresça utilizando a alimentação marcada. Para análise do fluxo metabólico estacionário, a célula deve atingir um steady state (chemistry)|estado estacionário (os isótopos que entram e saem da célula permanecem constantes com o tempo) ou em um estado quase estacionário (o estado estacionário é atingido por um determinado período de tempo).[11] O padrão isotópico do metabólito de saída é determinado. O padrão isotópico de saída fornece informações valiosas, que podem ser usadas para encontrar a magnitude do fluxo, a taxa de conversão de reagentes em produtos, através de cada reação.[12]
A figura demonstra a capacidade de usar marcadores diferentes para determinar o fluxo através de uma certa reação. Suponha que o metabólito original, um composto de três carbonos, tenha a capacidade de se dividir em um metabólito de dois carbonos e um metabólito de carbono em uma reação e depois recombinar ou permanecer um metabólito de três carbonos. Se a reação for fornecida com dois isótopos do metabólito na mesma proporção, um completamente marcado (círculos azuis), comumente conhecido como uniformemente marcado, e outro completamente não marcado (círculos brancos). O caminho no lado esquerdo do diagrama não exibe nenhuma alteração nos metabólitos, enquanto o lado direito mostra a divisão e a recombinação. Como mostrado, se o metabólito seguir apenas o caminho do lado esquerdo, ele permanecerá em uma proporção de 50–50 de metabólito uniformemente marcado para metabólito não marcado. Se o metabólito tomar apenas o lado direito, novos padrões de marcação podem ocorrer, todos em igual proporção. Outras proporções podem ocorrer dependendo de quanto do metabólito original segue o lado esquerdo da via versus o lado direito da via. Aqui as proporções são mostradas para uma situação em que metade dos metabólitos fica no lado esquerdo e metade no direito, mas outras proporções podem ocorrer.[13] Esses padrões de átomos marcados e átomos não marcados em um composto representam isotopômeros. Medindo a distribuição de isotopômeros dos metabólitos marcados de maneira diferente, o fluxo através de cada reação pode ser determinado.[14]
AFM combina os dados coletados da rotulagem isotópica com a estequiometria de cada reação, restrições, e um procedimento de otimização resolve um mapa de fluxo. As reações irreversíveis fornecem as restrições termodinâmicas necessárias para encontrar os fluxos. Uma matriz é construída a qual contém a estequiometria das reações. Os fluxos intracelulares são estimados pelo uso de um método iterativo no qual fluxos simulados são conectados ao modelo estequiométrico. Os fluxos simulados são exibidos em um mapa de fluxos, que mostra a taxa de reagentes sendo convertidos em produtos para cada reação.[12] Na maioria dos mapas de fluxo, quanto mais espessa a flecha, maior o valor do fluxo da reação.[15]
Entre as aplicações, as conformações de glicanos podem ser estudadas por espectroscopia de ressonância magnética nuclear usando acoplamentos spin-spin (acoplamentos J, acoplamentos escalares) e outros parâmetros de RMN que são sensíveis às geometrias de suas ligações glicosídicas constituintes e outros elementos móveis em seus componentes estruturais.[16]
Técnicas de medição de marcação de isótopos
[editar | editar código-fonte]Qualquer técnica para medir a diferença entre isotopômeros pode ser usada. Os dois métodos principais, ressonância magnética nuclear (RMN) e espectrometria de massa (MS), tem sido desenvolvidos para medir a massa de isotopômeros na marcação por isótopos estáveis.
RMN de prótons foi a primeira técnica usada para experimentos de marcação 13C. Usando esse método, cada posição protonada de carbono dentro de um determinado pool metabólico pode ser observado separadamente das outras posições.[17] Isso permite que a porcentagem de isotopômeros marcados nessa posição específica seja conhecida. O limite para RMN de prótons é que, se houver n átomos de carbono em um metabólito, só pode haver no máximo n diferentes valores de enriquecimento posicional, que é apenas uma pequena fração da informação total do isotopômero. Embora o uso de RMN de prótons de marcação seja limitante, experimentos puros de RMN de prótons são muito mais fáceis de avaliar do que experimentos com mais informações sobre isotopômeros.
Em adição a RMN de prótons, usando-se técnicas de RMN 13C permitirá uma visão mais detalhada da distribuição dos isotopômeros. Um átomo de carbono marcado produzirá diferentes sinais de divisão hiperfina, dependendo do estado de marcação de seus vizinhos diretos na molécula.[17] Um pico de singleto surge se os átomos de carbono vizinhos não forem marcados. Um pico de doubleto emerge se apenas um átomo de carbono vizinho for marcado. O tamanho da divisão em dupletos depende do grupo funcional do átomo de carbono vizinho. Se dois átomos de carbono vizinhos forem marcados, um dupleto de dupletos pode degenerar em um tripleto se as divisões do dupleto forem iguais.
As desvantagens de usar técnicas de RMN para propósitos de análise de fluxo metabólico é que é diferente de outras aplicações de RMN porque é uma disciplina bastante especializada. Um espectrômetro RMN pode não estar diretamente disponível para todas as equipes de pesquisa. A otimização dos parâmetros de medição RMN e a análise adequada das estruturas de pico requerem um especialista em RMN qualificado. Certos metabólitos também podem exigir procedimentos de medição especializados para obter dados adicionais de isotopômeros. Além disso, são necessárias ferramentas de software especialmente adaptadas para determinar a quantidade precisa de áreas de pico, bem como identificar a decomposição de picos entrelaçados de singleto, dupleto e tripleto.
Ao contrário da ressonância magnética nuclear, a espectrometria de massa (EM) é outro método mais aplicável e sensível a experimentos de análise de fluxo metabólico. Os instrumentos de EM estão disponíveis em diferentes variantes. Diferente da ressonância magnética nuclear bidimensional (RMN 2D), os instrumentos de MS trabalham diretamente com o hidrolisato.[17]
Na espectrometria de massa por cromatografia em fase gasosa (CG-EM), a EM é acoplada a um cromatógrafo a gás (CG) para separar os compostos do hidrolisado. Os compostos que eluem da coluna de CG são então ionizados e fragmentados simultaneamente. O benefício no uso de GC-EM é que não apenas os isotopômeros de massa do íon molecular são medidos, mas também o espectro de isotopômeros de massa de vários fragmentos, o que aumenta significativamente a informação medida.[18]
Em cromatografia líquida-espectrometria de massa (CL-EM), a CG é substituída por um cromatógrafo líquido.[19] A principal diferença é que a derivatização química não é necessária. Aplicações de CL-EM para AFM, no entanto, são raras.
Em cada caso, os instrumentos EM dividem uma distribuição específica de isotopômeros por seu peso molecular. Todos os isotopômeros de um metabólito específico que contêm o mesmo número de átomos de carbono marcados são coletados em um sinal de pico. Como todo isotopômero contribui para exatamente um pico no espectro EM, o valor percentual pode ser calculado para cada pico, produzindo a fração de massa do isotopômero.[17] Para um metabolito com n átomos de carbono, n+1 medições são produzidas. Após a normalização, permanecem exatamente n quantidades informativas de isotopômeros de massa.[17]
A desvantagem do uso de técnicas de EM é que, para cromatografia em fase gasosa, a amostra deve ser preparada por derivatização química, a fim de obter moléculas com carga. Existem inúmeros compostos utilizados para derivatizar amostras. N,N-Dimetilformamida dimetil acetal (DMFDMA)[20] e N-(tert-butildimetilsilil)-N-metiltrifluoroacetamida (MTBSTFA) [21] são dois exemplos de compostos que foram usados para derivar aminoácidos.
Além disso, fortes efeitos isotópicos observados afetam o tempo de retenção de isotopômeros marcados de maneira diferente na coluna de CG. A sobrecarga da coluna CG também deve ser evitada.[21]
Por fim, a abundância natural de outros átomos além do carbono também leva a uma perturbação no espectro de isotopômeros de massa. Por exemplo, cada átomo de oxigênio na molécula também pode estar presente como um isótopo 17O e como um isótopo 18O. Um impacto mais significativo da abundância natural de isótopos é o efeito do silício com uma abundância natural de isótopos 29Si e 30Si. Si é usado em agentes de derivatização para técnicas de EM.[17]
Marcador radioisotópico
[editar | editar código-fonte]A marcação radioisotópica é uma técnica para seguir o passo de uma amostra de substância através de um sistema. A substância é "marcada" ao incluir-se radionuclídeos em sua composição química. Quando estas decaem, sua presença pode ser determinada ao detetar-se a radiação emitida por eles. A marcação radioisotópica é um caso especial de marcação isotópica.[22]
Para estes propósitos, um tipo particularmente útil de decaimento radioativo é a emissão de pósitron. Quando um pósitron colide com um elétron, libera dois fótons de alta energia que viajam em direções diametralmente opostas. Se o pósitron é produzido em um objeto sólido, fará isto antes de viajar mais de um milímetro. Se ambos os fótons podem ser detectados, a localização do evento de desintegração pode ser determinada com muita precisão.[23][24]
Em um sentido estrito, a marcação radioisotópica inclui só os casos onde se introduz artificialmente a radioatividade no objeto de pesquisa, embora alguns fenômenos naturais permitam que ocorram fenômenos semelhantes. Em particular, a datação radiométrica usa um princípio intimamente relacionado.[25][26][27]
Aplicações em proteômica
[editar | editar código-fonte]Em proteômica, o estudo de todo o conjunto de proteínas expresso por um genoma, identificando biomarcadors de doenças pode envolver o uso de marcação isotópica estável por aminoácidos em cultivo celular (na literatura em inglês abreviado como SILAC, stable isotope labeling by amino acids in cell culture), que fornece formas marcadas isotópicas de aminoácidos usadas para estimar os níveis de proteínas.[28][29] Em proteínas recombinantes, proteínas manipuladas são produzidas em grandes quantidades e a marcação de isótopos é uma ferramenta para testar proteínas relevantes. O método usado para enriquecer seletivamente núcleos com 13C or 15N ou esgotar 1H delas. A recombinante seria expressa em E.coli com meios contendo cloreto de amônio-15N como uma fonte de nitrogênio.[30] A s proteínas marcadas com 15N resultantes são então purificadas pela afinidade do metal imobilizado e sua porcentagem estimada. Para aumentar o rendimento das proteínas marcadas e reduzir o custo dos meios marcados com isótopos, um procedimento alternativo aumenta principalmente a massa celular usando meio não marcado antes de introduzi-lo em uma quantidade mínima de meio marcado.[31] Outra aplicação da marcação isotópica seria na medição da síntese de DNA, que é a proliferação celular in vitro. Usa marcação por H3-timidina comparar padrão de síntese (ou sequência) em células.[32]
Aplicações para análise de processos ecossistêmicos
[editar | editar código-fonte]Traçadores isotópicos são usados para examinar processos em sistemas naturais, especialmente ambientes terrestres e aquáticos. Na ciência do solo traçadores 15N são usados extensivamente para estudar o ciclo do nitrogênio, enquanto os radioisótopos de carbono 13C e 14C, radioisótopos estáveis, respectivamente, são utilizados para estudar a rotatividade de compostos orgânicos e a fixação de CO2 por autótrofos. Por exemplo, Marsh et al. (2005) usaram ureia com marcação dupla (15N e 14C) para demonstrar a utilização do composto por oxidantes de amônia como fonte de energia (oxidação de amônia) e fonte de carbono (fixação quimioautotrófica de carbono).[33]
Aplicações para oceanografia
[editar | editar código-fonte]Os traçadores isotópicos também são usados extensivamente em oceanografia para estudar uma ampla variedade de processos. Os isótopos utilizados geralmente ocorrem naturalmente com fontes e taxas de formação e decaimento bem estabelecidas. No entanto, isótopos antropogênicos também podem ser utilizados com grande sucesso. Os pesquisadores medem as proporções isotópicas em diferentes locais e horários para inferir informações sobre os processos físicos do oceano.
Transporte de partículas
[editar | editar código-fonte]O oceano é uma extensa rede de transporte de partículas. Os isótopos de tório podem ajudar os pesquisadores a decifrar o movimento vertical e horizontal da matéria. 234Th tem uma taxa de produção constante e bem definida no oceano e meia-vida de 24 dias. Foi demonstrado que este isótopo de ocorrência natural varia linearmente com a profundidade. Portanto, quaisquer mudanças nesse padrão linear podem ser atribuídas ao transporte de 234Th em partículas. Por exemplo, baixas taxas isotópicas nas águas superficiais com valores muito altos a alguns metros abaixo indicariam um fluxo vertical na direção descendente. Além disso, o isótopo do tório pode ser traçado dentro de uma profundidade específica para decifrar o transporte lateral de partículas.[34]
Circulação
[editar | editar código-fonte]A circulação em sistemas locais, como baías, estuários e águas subterrâneas, pode ser examinada com isótopos de rádio. 223Ra tem meia-vida de 11 dias e pode ocorrer naturalmente em locais específicos nos rios e nas fontes de água subterrânea. A proporção isotópica do rádio diminuirá à medida que a água do rio fonte entra em uma baía ou estuário. Medindo a quantidade de 223Ra em vários locais diferentes, um padrão de circulação pode ser decifrado.[35] Esse mesmo processo exato também pode ser usado para estudar o movimento e a descarga das águas subterrâneas.[36]
Vários isótopos de chumbo podem ser usados para estudar a circulação em escala global. Oceanos diferentes (i.e. Atlântico, Pacífico, Índico, etc) tem assinaturas isotópicas diferentes. Isso resulta de diferenças nas proporções isotópicas de sedimentos e rochas nos diferentes oceanos.[37] Como os diferentes isótopos de chumbo têm meia-vida de 50 a 200 anos, não há tempo suficiente para que as relações isotópicas sejam homogeneizadas em todo o oceano. Portanto, análises precisas das relações isotópicas de Pb podem ser usadas para estudar a circulação dos diferentes oceanos.[38]
Processos tectônicos e mudanças climáticas
[editar | editar código-fonte]Isótopos com meia-vida extremamente longa podem ser usados para estudar processos de vários milhões de anos, como tectônica e mudanças climáticas extremas. A proporção isotópica de estrôncio (meia-vida ~2 Ma) pode ser analisado dentro de núcleos de gelo para examinar as mudanças ao longo da vida da Terra. As diferenças nessa proporção dentro do núcleo de gelo indicariam alterações significativas na geoquímica da Terra.[38]
Isótopos relacionados a armas nucleares
[editar | editar código-fonte]Os processos acima mencionados podem ser medidos usando isótopos que ocorrem naturalmente. No entanto, isótopos antropogênicos também são extremamente úteis para medições oceanográficas. Testes de armas nucleares liberaram uma infinidade de isótopos incomuns nos oceanos do mundo. 3H, 129I, e 137Cs podem ser encontrados dissolvidos na água do mar, enquanto 241Am e 238Pu estão ligados a partículas. Os isótopos dissolvidos na água são particularmente úteis no estudo da circulação global. Por exemplo, diferenças nas relações isotópicas laterais dentro de um oceano podem indicar fortes frentes de água ou giros.[39] Por outro lado, os isótopos ligados às partículas podem ser usados para estudar o transporte de massa dentro de colunas de água. Por exemplo, altos níveis de Am ou Pu pode indicar subsidência quando observado em grandes profundidades, ou afloramento (ressurgência) quando observado na superfície.[40]
Aplicações em síntese orgânica e bioquímica
[editar | editar código-fonte]A aplicação de intermediários de síntese orgânica e bioquímica marcados isotopicamente permite o rastreamento de passos de síntese e a detecção de rotas sintéticas otimizadas, assim como a obtenção dos isômeros mais adequados, como entre enantiômeros. Tais métodos de pesquisa tem grande aplicação na indústria de fármacos. Por exemplo, através da síntese de ácidos carboxílicos e ésteres marcados com C13, pode-se desenvolver sínteses de diversos derivados, como em sínteses de intermediários biossintéticos marcados isotopicamente análogos aos produtos naturais monocerina, hectoclorina e estrobilurina. Estre pesquisas desenvolvidas, estão as preparações de [9,10‐13C2] di-hidroisocumarina, utiliza-se uma condensação estereosseletiva de aldol do auxiliar quiral 13C2-acetilado para montar o fragmento C9-C14 marcado. As abordagens preferidas para as sínteses do ácido [1,2‐13C2] 5,5‐diclorohexanóico e do derivado N‐acetilcisteamina do ácido [1,2‐13C2] cinâmico envolvem respectivamente uma extensão de cadeia de Horner‐Wadsworth‐Emmons e reação de condensação de Knoevenagel.[41]
Aplicação em biologia
[editar | editar código-fonte]Entre exemplos das aplicações em biologia, pode-se encontrar a marcação isotópica para medição do fluxo metabólico da lignina em caules de Arabidopsis.[42]
Métodos para marcação isotópica
[editar | editar código-fonte]Síntese química
[editar | editar código-fonte]Processos de obtenção de substâncias, como a síntese química, tanto inorgânica como orgânica, são usados para obter-se a partir de compostos (reagentes) marcados isotopicamente outros compostos igualmente marcados.
A síntese química de compostos isotopicamente marcados é um pré-requisito para muitas investigações químicas, bioquímicas e medicinais. As restrições impostas pelos requisitos para rotulagem regioespecífica e, em alguns casos, a escala de tempo da síntese geralmente levam a estratégias sintéticas bastante diferentes daquelas usadas para o material não marcado.[43][44][45]
Como um exemplo simples de síntese orgânica de um composto isotopicamente marcado, pode-se citar a síntese do acetato de etila a partir do etanol, no caso marcado com 13C no carbono da extremidade sem hidroxila, e do ácido acético:
- CH3COOH + 13CH3CH2OH → CH3CO2CH213CH3 + H2O
Ácido malônico e seus ésteres e acetoacetato de etila são blocos comuns utilizados em síntese por reações de condensação para obter-se compostos marcados com isótopos de carbono. Malonato de etila pode ser preparado a partir de acetato de etila com oxalato de dietila e resultando em oxalacetato de dietila. Éster di-tert-butílico do ácido oxalacético pode ser hidrolisado sob condições medianamente ácidas. O oxalacetato de dietila também fornece uma diversidade de outros compostos marcados de quatro carbonos, como sendo reduzido no grupo cetona para fornecer um álcool, dando malato de etila, e sob desidratação, fumarato de dietila (trans-eteno-1,2-dicarboxilato de dietila). Ácido succínico pode ser obtido a partir de clorocacetato de etila.[45]pg 29
Lactamas, compostos tricíclicos antibacterianos podem ser sintetizados de blocos de construção molecular marcados com C14 como acetatos halogenados de alquilas.[46]pg 332
Pode-se sintetizar variedade isotopicamente marcada do metabólito urinário altamente abundante e biomedicamente importante ácido 3-(3-hidroxifenil)-3-hidroxipropiônico (HPHPA) por reação sonoquímica de Reformatsky mediada por índio.[47]
Troca mediada por enzimas
[editar | editar código-fonte]Usam-se reações catalisadas por enzimas para obter-se compostos marcados isotopicamente, como por exemplo a metilação de compostos bioquímicos com o agente metilante marcado, ou noutros processos, aminoácidos marcados.[48][49]
Pode-se, por exemplo, fazer pesquisas de sítios específicos de anticorpos baseado na catálise por enzimas.[50]
Noutro exemplo, uma abordagem enzimática usando endopeptidase de asparagina produzida bacterianamente por Oldenlandia affinis pode ser usada para marcação isotópica segmentar de uma proteína com sequências repetitivas, no caso uma proteína de repetição de tatu projetada, o que permite superar algumas das deficiências da ligação enzimática para marcação isotópica segmentar.[51]
Expressão recombinante de proteínas em meio marcado isotópico
[editar | editar código-fonte]A expressão recombinante de proteínas realizada em meio marcado isotópico permite produzir proteínas com aminoácidos e nucleobases marcados em posições específicas.[52]
Uma variedade de sistemas de expressão proteica recombinante tem sido desenvolvidos para genes heterólogos tanto para procarióticos e eucarióticos, como bactérias, leveduras, mamíferos, insetos, animais transgênicos e plantas.[53]
Protocolos foram desenvolvidos e aplicados para a produção de alto rendimento de U- 15N (uracila) ou U-13C, U-proteínas marcadas com 15N usando a metionina condicional auxotrófica de Escherichia coli B834.[54]
Referências
- ↑ Arthur W. Adamson; Química física, Volumen 1 (books.google.es)
- ↑ Patrizia Diana, Girolamo Cirrincione; Biosynthesis of Heterocycles: From Isolation to Gene Cluster; John Wiley & Sons, 2015. pág 52.
- ↑ Freeman, Ray. Magnetic Resonance in Chemistry and Medicine. New York: Oxford University Press, 2003.
- ↑ Jordan A. Hachtel et al; Identification of site-specific isotopic labels by vibrational spectroscopy in the electron microscope; February 1, 2019 - www.sciencemagazinedigital.org
- ↑ Basha M. (2020) Radioactivity. In: Analytical Techniques in Biochemistry. Springer Protocols Handbooks. Humana, New York, NY
- ↑ Richard Giles, Iris Kim, Weyjuin Eric Chao, Jennifer Moore, and Kyung Woon Jung; Dual Studies on a Hydrogen–Deuterium Exchange of Resorcinol and the Subsequent Kinetic Isotope Effect;Journal of Chemical Education 2014 91 (8), 1220-1223. DOI: 10.1021/ed500093g
- ↑ Blake, Michael E.; Bartlett, Kevin L.; Jones, Maitland (2003). «Am-Benzyne too-Benzyne Conversion through a 1,2-Shift of a Phenyl Group». Journal of the American Chemical Society. 125 (21): 6485–6490. ISSN 0002-7863. PMID 12785789. doi:10.1021/ja0213672
- ↑ Dickin, A. P., 2005. Radiogenic Isotope Geology, Cambridge University Press.
- ↑ a b Kruger, Nicholas; Antje von Schaewen (2003). «The oxidative pentose phosphate pathway: structure and organisation» (PDF). Current Opinion in Plant Biology. 6 (3): 236–246. PMID 12753973. doi:10.1016/s1369-5266(03)00039-6. Arquivado do original (PDF) em 15 de abril de 2012
- ↑ [1] Arquivado em abril 4, 2012, no Wayback Machine
- ↑ Wiechert, Wolfgang (2001). «13C Metabolic Flux Analysis». Metabolic Engineering. 3 (3): 195–206. PMID 11461141. doi:10.1006/mben.2001.0187
- ↑ a b Lee, Sang Yup; Park, Jong Myoung, and Kim, Tae Yong (2011). Chapter Four: Application of Metabolic Flux Analysis in Metabolic Engineering. Methods in Enzymology. 498. [S.l.: s.n.] pp. 67–93. ISBN 9780123851208. PMID 21601674. doi:10.1016/B978-0-12-385120-8.00004-8
- ↑ Stephanopoulos, Gregory; Aristos A. Aristidou (1998). «Chapter 9: Methods for the Experimental Determination of Metabolic Fluxes by Isotope Labeling». Metabolic engineering: principles and methodologies. San Diego: Academic Press. pp. 356–404. ISBN 978-0-12-666260-3
- ↑ Stephanopoulos, Gregory (1999). «Metabolic Fluxes and Metabolic Engineering». Metabolic Engineering. 1 (1): 1–11. PMID 10935750. doi:10.1006/mben.1998.0101
- ↑ Klamt, Steffen; Jorg Stelling, Martin Ginkel, and Ernst Dieter Gilles (2003). «FluxAnalyzer: exploring structure, pathways, and flux distributions in metabolic networks on interactive flux maps» (PDF). Bioinformatics. 19 (2): 261–269. doi:10.1093/bioinformatics/19.2.261
- ↑ Zhang, W., Pan, Q., & Serianni, A. S. (2016). A chemical synthesis of a multiply 13C-labeled hexasaccharide: a high-mannose N-glycan fragment. Journal of labelled compounds & radiopharmaceuticals, 59(14), 673–679. https://doi.org/10.1002/jlcr.3418
- ↑ a b c d e f Wiechert, Wolfgang (2001). «13C Metabolic Flux Analysis». Metabolic Engineering. 3 (3): 195–206. PMID 11461141. doi:10.1006/mben.2001.0187
- ↑ CHIARADIA, Mariza C.; COLLINS, Carol H.; JARDIM, Isabel C. S. F.. O estado da arte da cromatografia associada à espectrometria de massas acoplada à espectrometria de massas na análise de compostos tóxicos em alimentos. Quím. Nova, São Paulo, v. 31, n. 3, p. 623-636, 2008.
- ↑ de Graaf, A. A. (2000c). Use of 13C labeling and NMR spectroscopy in metabolic flux analysis. In NMR in Biotechnology: Theory and Applications (J.-N. Barbotin and J.-C. Portais, Eds.), Horizon Scientific Press.
- ↑ Christensen, B., and Nielsen, J. (2000). Metabolic network analysis of Penicillium chrysogenum using 13C-labeled glucose. Biotechnol. Bioeng. 68, 652�659.
- ↑ a b Dauner, M., and Sauer, U. (2000). GC-MS analysis of amino acids rapidly provides rich information for isotopomer balancing. Biotechnol. Prog. 16, 642-649.
- ↑ GREGORY R. CHOPPIN, JAN-OLOV LILJENZIN, JAN RYDBERG; Editor(s): GREGORY R. CHOPPIN, JAN-OLOV LILJENZIN, JAN RYDBERG; Radiochemistry and Nuclear Chemistry (Third Edition), CHAPTER 9 - Uses of Radioactive Tracers, Butterworth-Heinemann, 2002, Pages 239-282, ISBN 9780750674638.
- ↑ Encyclopedia of Behavioral Neuroscience; Elsevier, 2010. pág 189.
- ↑ Michael F. L'Annunziata; Editor(s): Michael F. L'Annunziata; Handbook of Radioactivity Analysis (Third Edition), Chapter 1 - Radiation Physics and Radionuclide Decay, Academic Press, 2012, Pages 1-162, ISBN 9780123848734.
- ↑ Sannappa Jadiyappa; Radioisotope: Applications, Effects, and Occupational Protection; September 19th 2018. DOI: 10.5772/intechopen.79161 - www.intechopen.com
- ↑ Fassbender, M.E. Guest Edited Collection: Radioisotopes and radiochemistry in health science. Sci Rep 10, 340 (2020).
- ↑ A. Canarache, I.I. Vintila, I. Munteanu; Elsevier's Dictionary of Soil Science: Definitions in English with French, German, and Spanish word translations; Elsevier, 2006. pág 693.
- ↑ "Stable Isotope Labeling with Amino Acid in Cell Culture."SILAC. Paydey Lab, n.d. Web. 23 Nov 2011.
- ↑ Carla Vanessa de Paula Lima; Ubiquitinoma quantitativo durante a metaciclogênese de Trypanosoma cruzi; Tese apresentada ao Instituto Carlos Chagas como parte dos requisitos para obtenção do título de Doutor em Biociências; CURITIBA/PR 2014. pg 98.
- ↑ Bunk, David.M. "Expression of Stable Isotopically Labeled Proteins for Use as Internal Standards for Mass Spectrometric Quantitation of Clinical Protein Biomarkers." NIST, material measurement laboratory. The National Institute of Standards and Technology (NIST) is an agency of the U.S. Department of Commerce, 30 Mar 2009. Web. 19 Nov 2011.
- ↑ Marley, Jonathan; Lu, Min; Bracken, Clay (2001). «A methode for efficient isotopic labeling and recombinent protein». Journal of Biomolecular labeling. 20: 71–75. doi:10.1023/a:1011254402785
- ↑ German, James. "The pattern of DNA synthesis in the chromosomes of human blood cells ." Rockefeller university press. 20.1 37–65. Print.
- ↑ Marsh, K. L., G. K. Sims, and R. L. Mulvaney. 2005. Availability of urea to autotrophic ammonia-oxidizing bacteria as related to the fate of 14C- and 15N-labeled urea added to soil. Biol. Fert. Soil. 42:137-145.
- ↑ Coppola, L.; Roy-Barman, M.; et al. (2006). «Thorium isotopes as tracers of particles dynamics and deep water circulation in the Indian sector of the Southern Ocean (ANTARES IV)». Marine Chemistry. 100 (3–4): 299–313. doi:10.1016/j.marchem.2005.10.019
- ↑ Hougham, A. L.; Moran, S. B.; et al. (2008). «Seasonal changes in submarine groundwater discharge to coastal salt ponds estimated using 226Ra and 228Ra as tracers». Marine Chemistry. 109 (3–4): 268–278. doi:10.1016/j.marchem.2007.08.001
- ↑ Swarzenski, P. W.; Reich, C.; et al. (2007). «Ra and Rn isotopes as natural tracers of submarine groundwater discharge in Tampa Bay, Florida». Marine Chemistry. 104 (1–2): 69–84. doi:10.1016/j.marchem.2006.08.001
- ↑ Hickey-Vargas, R.; Bizimis, M.; Deschamps, A. (2008). «Onset of the Indian Ocean isotopic signature in the Philippine Sea Plate: Hf and Pb isotope evidence from Early Cretaceous terranes». Earth and Planetary Science Letters. 268 (3–4): 255–267. Bibcode:2008E&PSL.268..255H. doi:10.1016/j.epsl.2008.01.003
- ↑ a b Haley, B. A.; Frank, M.; et al. (2008). «Radiogenic isotope record of Arctic Ocean circulation and weathering inputs of the past 15 million years». Paleoceanography. 23 (1): PA1S13. Bibcode:2008PalOc..23.1S13H. doi:10.1029/2007PA001486
- ↑ Povinec, P. P.; Breier, R.; et al. (2011). «Tracing of water masses using a multi isotope approach in the southern Indian Ocean». Earth and Planetary Science Letters. 302 (1–2): 14–26. Bibcode:2011E&PSL.302...14P. doi:10.1016/j.epsl.2010.11.026
- ↑ Lee, S.-H.; Povinec, P. P.; et al. (2009). «Radionuclides as tracers of water fronts in the South Indian Ocean – ANTARES IV Results». Journal of Oceanography. 65 (3): 397–406. doi:10.1007/s10872-009-0035-7
- ↑ Jordan, A.C., Axford, L.C., Harding, J.R., O'Connell, Y., Simpson, T.J. and Willis, C.L. (2007), Methods for the synthesis of carbon‐13 labelled acids and esters. J Label Compd Radiopharm, 50: 338-341.
- ↑ Peng Wang, Longyun Guo, Rohit Jaini, Antje Klempien, Rachel M. McCoy, John A. Morgan, Natalia Dudareva & Clint Chapple; A 13C isotope labeling method for the measurement of lignin metabolic flux in Arabidopsis stems; Plant Methods volume 14, Article number: 51 (2018).
- ↑ P. J. Paulsen and W. D. Cooke; Preparation of Deuterated Solvents for Nuclear Magnetic Resonance Spectrometry. Anal. Chem. 1963, 35, 10, 1560-1560.
- ↑ EGLINTON, G. Use of Isotopes in Organic Syntheses. Nature 184, 1830–1831 (1959).
- ↑ a b James R Hanson; The Organic Chemistry of Isotopic Labelling; RSC Publishing, 2011. ISBN 978-1-84973-188-1 eISBN 978-1-78801-818-0
- ↑ Rolf Voges, J. Richard Heys, Thomas Moenius. Preparation of Compounds Labeled with Tritium and Carbon-14. John Wiley & Sons, 2009.
- ↑ Khaniani, Yeganeh & Lipfert, Matthias & Bhattacharyya, Dipanjan & Pérez-Pineiro, Rolando & Zheng, Jiamin & Wishart, David. (2018). A Simple and Convenient Synthesis of Unlabeled and 13C-Labeled 3-(3-Hydroxyphenyl)-3-Hydroxypropionic Acid and Its Quantification in Human Urine Samples. Metabolites. 8. 80.
- ↑ Zvi Kelman (editor); Methods In Enzymology Volume 565 - Isotope Labeling of Biomolecules – Labeling Methods; Academic Press, 2015.
- ↑ Vladimir Zaikin, John M. Halket; A Handbook of Derivatives for Mass Spectrometry; IM Publications, 2009. pág. 378
- ↑ Zeglis BM, Davis CB, Aggeler R, Kang HC, Chen A, Agnew BJ, Lewis JS. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjug Chem. 2013 Jun 19;24(6):1057-67. doi: 10.1021/bc400122c. Epub 2013 May 30. PMID 23688208; PMCID: PMC3714844.
- ↑ Kornelia M. Mikula, Luisa Krumwiede, Andreas Plückthun, Hideo Iwaï; Segmental isotopic labeling by asparaginyl endopeptidase-mediated protein ligation; Journal of Biomolecular NMR (2018) 71:225–235.
- ↑ Marley, Jonathan & Lu, Min & Bracken, Clay. (2001). A Method for Efficient Isotopic Labeling of Recombinant Proteins. Journal of biomolecular NMR. 20. 71-5. 10.1023/A:1011254402785.
- ↑ Giancarlo Basile, Manuela Peticca; Recombinant Protein Expression in Leishmania tarentolae; Mol Biotechnol (2009) 43:273–278 DOI 10.1007/s12033-009-9213-5.
- ↑ Robert C. Tyler, Hassan K. Sreenath, Shanteri Singh, David J. Aceti, Craig A. Bingman, John L. Markley, Brian G. Fox; Auto-induction medium for the production of [U- 15N- and [U- 13C, U- 15N]-labeled proteins for NMR screening and structure determination; Protein Expression and Purification 40 (2005) 268–278.
