Pentraxinas
| Família das pentraxinas | |
|---|---|
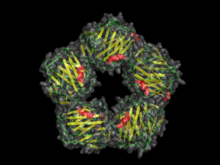
| CRP drawn from PDB 1B09 | |
| Indicadores | |
| Símbolo | Pentraxina |
| Pfam | PF00354 |
| InterPro | IPR001759 |
| SCOP | 1sac |
| Estruturas PDB disponíveis: 1limD:32-237 2a3wF:26-219 2a3xH:26-219 1lgnC:26-219 2a3yD:26-219 1gykA:26-219 1sacC:26-219 1hasB:29-222 1crvE:25-220 1lj7D:25-220 1b09C:25-220 1gnhA:25-220 | |
As pentraxinas, também conhecidas como pentaxinas, são uma família conservada evolutivamente de proteínas caracterizadas por um domínio proteico de pentraxina. As proteínas da família da pentraxina são envolvidas em respostas imune agudas.[1] Elas são conhecidas como proteínas de fase aguda (APP) por mais de um século.[2]
Estrutura[editar | editar código-fonte]
As pentranias são caracterizadas pela dependência de cálcio para ligação e uma estrutura chama em inglês de "flattened β-jellyroll", semelhante à de lectinas de legumes.[3] O nome "pentraxina" é derivado das palavras gregas para 5 (penta) e frutas silvestres (ragos), devido a simetria radial de 5 monômeros formando um anel de 95Å de diâmetro e 35Å de profundidade nos primeiros membros identificados. As pentraxinas "curtas" incluem o componente amiloide sérico P (SAP) e a proteína C reativa (CRP).As pentraxinas "longas" incluem PTX3 (uma molécula modulada por citocinas) e diversas pentraxinas neuronais.
Membros da família[editar | editar código-fonte]
3 dos principais membtros da família são proteínas séricas: a proteína C reativa (CRP),[4] o componente amiloide sérico P (SAP),[5] e a proteína de fêmea (FP).[6] A proteína PTX3 (ou TSG-14) é uma proteína induzida por citocina homóloga à CRP, mas sem função conhecida.
Proteína C-reativa[editar | editar código-fonte]
A proteína C reativa é expressa durante a fase aguda de resposta ao dano tissular ou inflamação em mamíferos. A proteína assemelha-se a anticorpos e executa diversas funções associadas com a defesa do hospedeiro: promoção de aglutinação, inchaço da capsula bacteriana e fagocitose, além de ativar a via cássica do complemento através da sua ligação dependente de cálcio à fosfocolina.[4] CRPs já foram sequenciadas em um invertebrado, Limulus polyphemus, onde constituem parte normal da hemolinfa
Componente amiloide sérico P[editar | editar código-fonte]
Componente amiloide sérico P é uma proteína de vertebrados idêntica às formas tissulares do componente amiloide P. Ele é encontrado em todos os tipos de depósitos amiloides, na mebrana basal glomerular e em fibra elásticas nos vasos sanguíneos. SAP liga-seà diversos ligantes de lipoproteínas de forma dependente de cálcio e foi sugerido que, em mamíferos, isso pode ter implicações importantes na aterosclerose e na amiloidose..[5]
Proteína de fêmea de hamster[editar | editar código-fonte]
A proteína de fêmea de hamster é homóloga ao SAP e é encontrada em Mesocricetus auratus (Hamster sírio). A concentração dessa proteína é alterada por esteroides sexuais.[6]
Sistema nervoso[editar | editar código-fonte]
Pentraxinas expressas no sistema nervoso são as pentraxinas neurais I (NPTXI) e II (NPTXII).[7] NPTXI e NPTXII são homólogas e podem coexistir em uma mesma espécie. Sugere-se que ambas as proteínas medeiem a captação de macromoléculas sinápticas e participem da plasticidade sináptica. A apexina, uma proteína espermática acrossomal, é um homólogo de NPTXII encontrada em Cavia porcellus (Porquinho-da-índia).[8]
Humano[editar | editar código-fonte]
Genes humanos codificando proteínas que contém esse domínio incluem:
- APCS
- CRP
- GPR144
- NPTX1; NPTX2; NPTXR
- PTX3
- SVEP1
Referências
- ↑ Gewurz H, Zhang XH, Lint TF (1995). «Structure and function of the pentraxins». Curr. Opin. Immunol. 7 (1): 54–64. PMID 7772283. doi:10.1016/0952-7915(95)80029-8
- ↑ Martinez de la Torre, Y; Fabbri, M (1 de maio de 2010). «Evolution of the pentraxin family: the new entry PTX4.». Journal of immunology. 184 (9): 5055-64. PMID 20357257. doi:10.4049/jimmunol.0901672
- ↑ Emsley J, White HE, O'Hara BP, Oliva G, Srinivasan N, Tickle IJ, Blundell TL, Pepys MB, Wood SP (janeiro de 1994). «Structure of pentameric human serum amyloid P component». Nature. 367 (6461): 338–45. PMID 8114934. doi:10.1038/367338a0
- ↑ a b Romero IR, Morris C, Rodriguez M, Mold C, Du Clos TW (1998). «Inflammatory potential of C-reactive protein complexes compared to immune complexes». Clin. Immunol. Immunopathol. 87 (2): 155–162. PMID 9614930. doi:10.1006/clin.1997.4516
- ↑ a b Yutani C, Shimokado K, Li XA (1998). «Serum amyloid P component associates with high density lipoprotein as well as very low density lipoprotein but not with low density lipoprotein». Biochem. Biophys. Res. Commun. 244 (1): 249–252. PMID 9514915. doi:10.1006/bbrc.1998.8248
- ↑ a b Coe JE, Ross MJ (1997). «Electrophoretic polymorphism of a hamster pentraxin, female protein (amyloid P component)». Scand. J. Immunol. 46 (2): 180–182. PMID 9583999. doi:10.1046/j.1365-3083.1997.d01-109.x
- ↑ Perin MS, Omeis IA, Hsu YC (1996). «Mouse and human neuronal pentraxin 1 (NPTX1): conservation, genomic structure, and chromosomal localization». Genomics. 36 (3): 543–545. PMID 8884281. doi:10.1006/geno.1996.0503
- ↑ Reid MS, Blobel CP (1994). «Apexin, an acrosomal pentaxin». J. Biol. Chem. 269 (51): 32615–32620. PMID 7798266