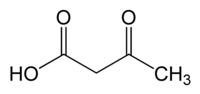
Ácido acetoacético
| Ácido acetoacético Alerta sobre risco à saúde | |
|---|---|
| |
| |
| Nome IUPAC | 3-oxobutanóico, ácido diacético |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| KEGG | |
| SMILES |
|
| InChI | 1/C4H6O3/c1-3(5)2-4(6)7/h2H2,1H3,(H,6,7)
|
| Propriedades | |
| Fórmula molecular | C4H6O3 |
| Massa molar | 102.09 g/mol |
| Aparência | Sólido cristalino ou líquido viscoso[1] |
| Ponto de fusão |
36.5 °C |
| Ponto de ebulição |
Decompõe-se |
| Solubilidade em água | Solúvel[1] |
| Acidez (pKa) | 3.58[2] |
| Compostos relacionados | |
| Outros aniões/ânions | Acetoacetamida |
| Cetoácidos relacionados | Ácido 2-oxobutírico (isômero) Ácido alfa-hidroxiacetoacético (mais uma hidroxila no carbono 2) Ácido 2-metilacetoacético (mais um metil no carbono 2) Ácido 3-oxopentanoico e ácido levulínico (4-oxopentanoico) |
| Compostos relacionados | Ácido beta-hidroxibutírico (cetona reduzida a álcool) 3-Oxobutanal (ácido reduzido a aldeído) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácido acetoacético é o nome usual do ácido 3-Oxobutanóico. Já foi também comumente designado como ácido diacético, termo atualmente em desuso.
Obtenção e preparação[editar | editar código-fonte]
O ácido acetoacético é obtido por saponificação (hidrólise) do acetoacetato de etila e acidificação do acetoacetato salino obtido.[3]
Outra possibilidade para sua síntese é a oxidação do ácido butírico com peróxido de hidrogênio.
Propriedades[editar | editar código-fonte]
No ácido acetoacético ocorre a chamada tautomeria cetoenólica. Como consequência do efeito indutivo do grupamento cetônico, o ácido acetoacético é mais ácido que o seu homólogo, o ácido butírico.
Utilização[editar | editar código-fonte]
O ácido acetoacético puro é raramente utilizado, já que se decompõe facilmente por descarboxilação formando acetona e dióxido de carbono, sobretudo em temperaturas mais altas.
Em geral, o ácido acetoacético é gerado a 0 °C e usado in situ imediatamente.[4] A forma ácida tem uma meia vida de 140 minutos a 37°C em meio aquoso, enquanto a forma básica (o ânion) tem meia vida de 130 horas, ou seja, decompõe-se 50 vezes mais lentamente.[5] Muito mais estáveis e importantes, como intermediários sintéticos e reagentes, são os seus ésteres e sais.
Significado biológico[editar | editar código-fonte]
O ácido acetoacético é, tal como seu isômero, o ácido 2-oxobutanóico, produto intermediário no metabolismo dos ácidos graxos. É um dos chamados corpos cetônicos e tem significado especial na fisiologia da desnutrição e da dieta. Em estado de desnutrição, a escassez de intermediários do ciclo de Krebs procedentes do metabolismo de glicídios ou de aminoácidos, leva ao acúmulo de acetilcoenzima A, dando origem ao processo conhecido como cetose.
Referências
- ↑ a b Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Dawson, R. M. C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ↑ Robert C. Krueger (1952). «Crystalline Acetoacetic Acid». Journal of the American Chemical Society. 74 (21): 5536–5536. doi:10.1021/ja01141a521
- ↑ George A. Reynolds and J. A. VanAllan "Methylglyoxal-?-Phenylhydrazone" Organic Syntheses, Collected Volume 4, p.633 (1963).http://www.orgsyn.org/orgsyn/pdfs/CV4P0633.pdf Arquivado em 27 de setembro de 2007, no Wayback Machine.
- ↑ Hay, R. W.; Bond, M. A. (1967). «Kinetics of decarboxilation of acetoacetic acid». Aust. J. Chem. 20 (9): 1823–8. doi:10.1071/CH9671823
Literatura[editar | editar código-fonte]
- Beilsteins Handbuch der Organischen Chemie E III 3; 1178

