Cloreto de tionila
| Cloreto de tionila Alerta sobre risco à saúde | |
|---|---|

| |

| |
| Outros nomes | oxicloreto sulfuroso dicloreto sulfuroso cloreto de sulfinila dicloreto de sulfinila diclorosulfóxido |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | SOCl2 |
| Massa molar | 118.97 g/mol |
| Aparência | líquido com forte odor claro a amarelado |
| Densidade | 1.638 g ml−1, líquido |
| Ponto de fusão |
−104.5 °C |
| Ponto de ebulição |
76 °C |
| Solubilidade em água | Reativo |
| Viscosidade | 0.6 cP at ? °C |
| Estrutura | |
| Forma molecular | piramidal |
| Momento dipolar | 1.4 D |
| Riscos associados | |
| MSDS | External MSDS |
| Classificação UE | Corrosivo (C) |
| NFPA 704 | |
| Frases R | R14, R20/22, R29, R35 |
| Frases S | S1/2, S26, S36/37/39, S45 |
| Ponto de fulgor | não inflamável |
| Compostos relacionados | |
| Compostos relacionados | Cloreto de sulfurila Oxidicloreto de selênio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Cloreto de tionila (ou cloreto de tionilo ou ainda dicloreto de tionila) é um composto inorgânico com a fórmula SOCl2. SOCl2 é um reagente químico usado em reações de cloração. É um líquido incolor, destilável a temperatura ambiente que decompõe-se acima de 140 °C. SOCl2 é algumas vezes confundido com cloreto de sulfurila, SO2Cl2, mas as propriedades químicas destes compostos de S (IV) e S (VI) diferem significativamente.
Propriedades e estrutura
[editar | editar código-fonte]A molécula SOCl2 é piramidal, indicando a presença de um par solitário de elétrons sobre o centro do S(IV). Em contraste, COCl2 é planar.
SOCl2 reage com água desprendendo ácido clorídrico e dióxido de enxofre.
Por causa de sua alta reatividade com água, SOCl2 não é previsto como ocorrente na natureza.
Produção
[editar | editar código-fonte]A principal síntese industrial envolve a reação de trióxido de enxofre e dicloreto de enxofre:[1]
Outros métodos incluem
- SO2 + PCl5 → SOCl2 + POCl3;
- SO2 + Cl2 + SCl2 → 2 SOCl2;
- SO3 + Cl2 + 2 SCl2 → 3 SOCl2.
A primeira das três reações acima também produz oxicloreto de fósforo (ou cloreto de fosforilo), o qual assemelha-se a cloreto de tionila em muitas de suas reações.
Aplicações
[editar | editar código-fonte]Cloreto de tionila é principalmente usado na produção industrial de compostos organoclorados, os quais são frequentemente intermediários na produção de fármacos e substâncias agroquímicas.
Química orgânica
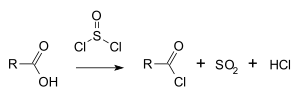
[editar | editar código-fonte]Cloreto de tionila é largamente usado em síntese orgânica para algumas aplicações, requer purificação.[2] Classicamente, converte ácidos carboxílicos a cloretos de acila:[3]
Álcoois reagem com cloreto de tionila resultando os correspondentes cloretos de alquila na reação de Darzens.[4]
Referências
- ↑ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, 1984.
- ↑ Friedman, L. and Wetter, W. P., "Purification of Thionyl Chloride", J. Chem. Soc. A, 1967, 36-8.doi:10.1039/J19670000036
- ↑ Allen, C. F. H.; Byers, Jr., J. R.; Humphlett, W. J. (1963). «Oleoyl chloride». Org. Synth.; Coll. Vol., 4; Rutenberg, M. W.; Horning, E. C. (1963). «1-Methyl-3-ethyloxindole». Org. Synth.; Coll. Vol., 4
- ↑ Mondanaro, K. R.; Dailey, W. P. (2004). «3-Chloro-2-(chloromethyl)-1-propene». Org. Synth.; Coll. Vol., 10; Krakowiak, K. E.; Bradshaw, J. S. (1998). «4-Benzyl-10,19-diethyl-4,10,19-triaza-1,7,13,16-tetraoxacycloheneicosane». Org. Synth.; Coll. Vol., 9; Feng Xu, Bryon Simmons, Robert A. Reamer, Edward Corley, Jerry Murry, and David Tschaen (2008). «Chlorination/Cyclodehydration of Amino Alcohols with SOCl2: An Old Reaction Revisited». J. Org. Chem. 73 (1): 312–5. PMID 18052293. doi:10.1021/jo701877h