Neurogenômica
A neurogenômica é o estudo de como o genoma de um organismo influencia o desenvolvimento e a função do seu sistema nervoso.[1] Este campo pretende unir a genômica funcional e a neurobiologia para entender o sistema nervoso como um todo a partir de uma perspectiva genômica.
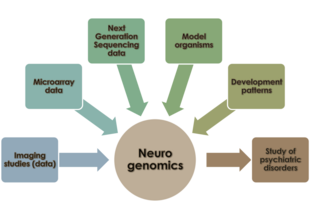
O sistema nervoso em vertebrados é composto por dois tipos principais de células – células neurogliais e neurônios. Centenas de tipos diferentes de neurônios existem em humanos, com funções variadas – alguns deles processam estímulos externos; outros geram uma resposta a estímulos; outros se organizam em estruturas centralizadas (cérebro, gânglios da raiz dorsal) que são responsáveis pela cognição, percepção e regulação das funções motoras. Neurônios nesses locais centralizados tendem a se organizar em redes gigantes e se comunicam extensivamente uns com os outros. Antes da disponibilidade de matrizes de expressão e metodologias de sequenciamento de DNA, os pesquisadores procuraram entender o comportamento celular dos neurônios (incluindo a formação de sinapses e desenvolvimento neuronal e regionalização no sistema nervoso humano) em termos de biologia molecular e bioquímica subjacentes, sem qualquer compreensão da influência do genoma de um neurônio em seu desenvolvimento e comportamento. À medida que nossa compreensão do genoma se expandiu, o papel das redes de interações gênicas na manutenção da função e do comportamento neuronal atraiu interesse na comunidade de pesquisa em neurociência. A neurogenômica permite que os cientistas estudem o sistema nervoso dos organismos no contexto dessas redes reguladoras e transcricionais subjacentes. Essa abordagem é distinta da neurogenética, que enfatiza o papel de genes únicos sem um contexto de interação em rede ao estudar o sistema nervoso.[2]
Abordagens
[editar | editar código-fonte]Advento da biologia de alto rendimento
[editar | editar código-fonte]Em 1999, Cirelli & Tononi[3] relataram pela primeira vez a associação de perfis de expressão de genes cerebrais em todo o genoma (usando microarranjo) com um fenótipo comportamental em camundongos. Desde então, os dados de expressão gênica global do cérebro, derivados de microarranjos, foram alinhados a vários loci de características quantitativas comportamentais (QTLs) e relatados em várias publicações.[4][5][6] No entanto, as abordagens baseadas em microarranjos têm seus próprios problemas que confundem a análise - a saturação da sonda pode resultar em uma variação mensurável muito pequena da expressão gênica entre indivíduos geneticamente únicos,[7] e a presença de polimorfismos de nucleotídeo único (SNPs) pode resultar em artefatos de hibridização.[8][9] Além disso, devido à sua natureza baseada em sonda, os microarranjos podem perder muitos tipos de transcritos (ncARNs, miARNs e isoformas de mARN). As sondas também podem ter afinidades de ligação específicas da espécie que podem confundir a análise comparativa.
Abordagens de sequenciamento de última geração
[editar | editar código-fonte]Estudos com gêmeos revelaram que esquizofrenia,[10] transtorno bipolar,[11] transtorno do espectro do autismo (TEA),[12][13] e transtorno de déficit de atenção e hiperatividade[14] (TDAH) são transtornos psiquiátricos geneticamente complexos e altamente hereditários. No entanto, estudos de ligação falharam em grande parte na identificação de variantes causadoras de transtornos psiquiátricos como esses, principalmente por causa de sua arquitetura genética complexa. Múltiplas variantes de risco de baixa penetrância podem ser agregadas em indivíduos e famílias afetadas, e conjuntos de variantes causais podem variar entre as famílias. Estudos nessa linha determinaram uma base poligênica para diversos transtornos psiquiátricos.[15] Descobriu-se que várias mutações de novo que ocorrem independentemente em pacientes com doença de Alzheimer interrompem um conjunto compartilhado de vias funcionais envolvidas com a sinalização neuronal, por exemplo.[16] A busca para entender a biologia causadora de transtornos psiquiátricos é, portanto, muito auxiliada pela capacidade de analisar genomas inteiros de indivíduos afetados e não afetados de maneira imparcial.[17]
Com a disponibilidade de metodologias de sequenciamento de próxima geração massivamente paralelas, os cientistas foram capazes de olhar além das capturas baseadas em sondas de genes expressos. RNA-seq, por exemplo, identifica 25-60% mais genes expressos do que os microarranjos. No campo da neurogenômica, espera-se que, ao entender os perfis genômicos de diferentes partes do cérebro, possamos melhorar nossa compreensão de como as interações entre genes e vias influenciam a função e o desenvolvimento celular. Espera-se que essa abordagem seja capaz de identificar as redes gênicas secundárias que são interrompidas em distúrbios neurológicos, auxiliando posteriormente os estratagemas de desenvolvimento de drogas para doenças cerebrais.[18] A iniciativa BRAIN lançada em 2013, por exemplo, busca “informar o desenvolvimento de futuros tratamentos para distúrbios cerebrais, incluindo doença de Alzheimer, epilepsia e lesão cerebral traumática”.
Estudos de imagem e mapeamento óptico
[editar | editar código-fonte]Quando o autismo foi identificado como um distúrbio biológico distinto na década de 1980, os pesquisadores descobriram que indivíduos autistas apresentavam uma anormalidade de crescimento cerebral no cerebelo em seus primeiros anos de desenvolvimento.[19] Pesquisas subsequentes indicaram que 90% das crianças autistas têm um volume cerebral maior do que seus pares de 2 a 4 anos de idade e mostram uma expansão no conteúdo de substância branca e cinzenta no cérebro.[20] A substância branca e cinzenta no cérebro está associada ao aprendizado e à cognição, respectivamente, e a formação de placas amilóides na substância branca tem sido associada à doença de Alzheimer. Esses achados destacaram a influência da variação estrutural no cérebro em transtornos psiquiátricos e motivaram o uso de tecnologias de imagem para mapear regiões de divergência entre cérebros saudáveis e doentes. Além disso, embora nem sempre seja possível recuperar espécimes biológicos de diferentes áreas do cérebro humano, as técnicas de neuroimagem oferecem um meio não invasivo para entender a base biológica dos distúrbios neurológicos. Espera-se que uma compreensão dos padrões de localização de diferentes doenças psiquiátricas possa, por sua vez, informar estudos de análise de rede em neurogenômica.
Ressonância magnética
[editar | editar código-fonte]A ressonância magnética estrutural pode ser usada para identificar a composição estrutural do cérebro. Particularmente no contexto da neurogenômica, a ressonância magnética tem desempenhado um papel extenso no estudo da doença de Alzheimer nas últimas quatro décadas. Foi inicialmente usada para descartar outras causas de demência,[16] mas estudos recentes indicaram a presença de alterações características em pacientes com doença de Alzheimer. Como resultado, os exames de ressonância magnética estão sendo usados atualmente como uma ferramenta de neuroimagem para ajudar a identificar a fisiopatologia temporal e espacial da doença de Alzheimer, como alterações cerebrais específicas e imagens amiloides.[16]
Modelos de pesquisa
[editar | editar código-fonte]Em humanos
[editar | editar código-fonte]As abordagens atuais na coleta de dados de expressão gênica em cérebros humanos são usar microarranjos ou RNA-seq. Atualmente, é raro coletar tecido cerebral "in vivo" - somente quando os tratamentos envolvem cirurgia no cérebro há uma chance de que o tecido cerebral seja coletado durante o procedimento. É o caso da epilepsia.
Atualmente, os dados de expressão gênica geralmente são coletados em cérebros post mortem e isso geralmente é uma barreira para a pesquisa neurogenômica em humanos.[21][22] Após a morte, a quantidade de tempo entre a morte e quando os dados do cérebro post mortem são coletados é conhecido como intervalo post mortem. Como o RNA se degrada após a morte, um cérebro novo é ideal – mas nem sempre disponível. Isso, por sua vez, pode influenciar uma variedade de análises posteriores.
Modelos animais
[editar | editar código-fonte]Peixe-zebra
[editar | editar código-fonte]O desenvolvimento do peixe-zebra depende de redes de genes altamente conservadas entre todos os vertebrados.[23] Além disso, com um conjunto extremamente bem anotado de 12.000 genes e 1.000 mutantes de desenvolvimento inicial que são realmente visíveis nos embriões e larvas de peixe-zebra opticamente claros, o peixe-zebra oferece um sistema sofisticado para mutagênese e imagens em tempo real de patologias em desenvolvimento. Este modelo de desenvolvimento inicial foi empregado para estudar o sistema nervoso em resolução celular.[24][25] O sistema modelo de peixe-zebra já foi usado para estudar a neuroregeneração[26] e doenças humanas poligênicas graves, como câncer e doenças cardíacas.[27] Vários mutantes de peixe-zebra com variações comportamentais em resposta à dosagem de cocaína e álcool foram isolados e também podem formar uma base para o estudo da patogênese de distúrbios comportamentais.[28][29]
Roedores
[editar | editar código-fonte]Modelos de roedores têm sido proeminentes no estudo de distúrbios humanos. Esses modelos foram extensivamente anotados com homólogos de genes de vários distúrbios monogênicos em humanos. Estudos de nocaute desses homólogos levaram à expansão de nossa compreensão das interações em rede de genes em tecidos humanos. Por exemplo, o gene FMR1 tem sido implicado com autismo em uma série de estudos de rede.[30][31] Usando um nocaute de FMR1 em camundongos cria o modelo para a Síndrome do X Frágil, um dos distúrbios do espectro do autismo.[32]
Expressão gênica no cérebro
[editar | editar código-fonte]O perfil de expressão gênica do sistema nervoso central (SNC) é único. Oitenta por cento de todos os genes humanos são expressos no cérebro; 5.000 desses genes são expressos exclusivamente no SNC. O cérebro humano tem a maior quantidade de expressão gênica de todos os cérebros de mamíferos estudados. Em comparação, os tecidos fora do cérebro terão níveis de expressão mais semelhantes em comparação com os seus homólogos de mamíferos. Uma fonte dos níveis de expressão aumentados no cérebro humano é da região de codificação não proteica do genoma. Numerosos estudos indicaram que o cérebro humano tem um nível mais alto de expressão em regiões reguladoras em comparação com outros cérebros de mamíferos. Há também um enriquecimento notável para mais eventos de splicing alternativo no cérebro humano.[2]
Diferenças espaciais
[editar | editar código-fonte]Os perfis de expressão gênica também variam dentro de regiões específicas do cérebro. Um estudo de microarray mostrou que o perfil do transcriptoma dos aglomerados do SNC se agrupa com base na região. Um estudo diferente caracterizou a regulação da expressão gênica em 10 regiões diferentes com base em seus sinais eQTL .[33] A causa dos perfis de expressão variados está relacionada à função, migração de neurônios e heterogeneidade celular da região. Mesmo as três camadas do córtex cerebral têm perfis de expressão distintos.[34]
Evolução do cérebro dos mamíferos
[editar | editar código-fonte]A evolução do Homo sapiens desde a divergência do ancestral comum primata mostrou uma expansão acentuada no tamanho e complexidade do cérebro, especialmente no córtex cerebral.[35][36][37][38] Em comparação com os primatas, o córtex cerebral humano tem uma área de superfície aumentada, mas difere apenas ligeiramente em espessura. Muitos estudos em larga escala para entender as diferenças do cérebro humano de outras espécies indicaram expansão de famílias de genes e mudanças no splicing alternativo como responsáveis pelo aumento corolário das capacidades cognitivas e comportamento cooperativo em humanos.[39][40] No entanto, ainda estamos para determinar as consequências fenotípicas exatas de todas essas mudanças. Uma dificuldade é que apenas os primatas desenvolveram subdivisões em seu córtex cerebral, dificultando a modelagem de problemas neurológicos específicos humanos em roedores.[37][41][42]
Distúrbios
[editar | editar código-fonte]
Os distúrbios neurogenômicos se manifestam como distúrbios neurológicos com uma arquitetura genética complexa e um padrão de herança não-mendeliano.[18] Alguns exemplos desses distúrbios incluem transtorno bipolar e esquizofrenia.[15] Vários genes podem estar envolvidos na manifestação do distúrbio, e as mutações nesses distúrbios são geralmente raras e de novo. Portanto, torna-se extremamente improvável observar a mesma variante (potencialmente causadora) em dois indivíduos não relacionados afetados pelo mesmo distúrbio neurogenômico.[15] A pesquisa em andamento implicou várias variações exônicas de novo e variações estruturais no Transtorno do Espectro do Autismo (TEA), por exemplo.[15] O espectro alélico das variantes raras e comuns em distúrbios neurogenômicos, portanto, exige a necessidade de grandes estudos de grupos para excluir efetivamente variantes de baixo efeito e identificar as vias abrangentes frequentemente mutadas nos diferentes distúrbios, em vez de genes específicos e mutações específicas de alta penetrância.
Análise de rede
[editar | editar código-fonte]O principal objetivo da análise de rede em neurogenômica é identificar associações não aleatórias estatisticamente significativas entre genes que contêm variantes de risco.[15] Embora já existam várias implementações de algoritmos desta abordagem,[43][44] os passos gerais para análise de rede permanecem os mesmos.
Ver também
[editar | editar código-fonte]Referências
- ↑ Boguski, Mark S.; Jones, Allan R. (1 de maio de 2004). «Neurogenomics: at the intersection of neurobiology and genome sciences». Nature Neuroscience. 7 (5): 429–433. ISSN 1097-6256. PMID 15114353. doi:10.1038/nn1232
- ↑ a b Jain, Kewal K. (1 de janeiro de 2013). «Neurogenetics and Neurogenomics». Applications of Biotechnology in Neurology (em inglês). [S.l.]: Humana Press. pp. 7–16. ISBN 9781627032711. doi:10.1007/978-1-62703-272-8_2
- ↑ Cirelli, Chiara; Tononi, Giulio (1999). «Differences in gene expression during sleep and wakefulness». Annals of Medicine. 31 (2): 117–124. PMID 10344584. doi:10.3109/07853899908998787
- ↑ Matthews, Douglas B.; Bhave, Sanjiv V.; Belknap, John K.; Brittingham, Cynthia; Chesler, Elissa J.; Hitzemann, Robert J.; Hoffmann, Paula L.; Lu, Lu; McWeeney, Shannon (1 de setembro de 2005). «Complex genetics of interactions of alcohol and CNS function and behavior». Alcoholism, Clinical and Experimental Research. 29 (9): 1706–1719. ISSN 0145-6008. PMID 16205371. doi:10.1097/01.alc.0000179209.44407.df
- ↑ Hoffman, Paula L.; Miles, Michael; Edenberg, Howard J.; Sommer, Wolfgang; Tabakoff, Boris; Wehner, Jeanne M.; Lewohl, Joanne (1 de fevereiro de 2003). «Gene expression in brain: a window on ethanol dependence, neuroadaptation, and preference». Alcoholism, Clinical and Experimental Research. 27 (2): 155–168. ISSN 0145-6008. PMID 12605065. doi:10.1097/01.ALC.0000060101.89334.11
- ↑ Farris, Sean P.; Miles, Michael F. (1 de janeiro de 2012). «Ethanol modulation of gene networks: implications for alcoholism». Neurobiology of Disease. 45 (1): 115–121. ISSN 1095-953X. PMC 3158275
 . PMID 21536129. doi:10.1016/j.nbd.2011.04.013
. PMID 21536129. doi:10.1016/j.nbd.2011.04.013
- ↑ Pozhitkov, Alex E.; Boube, Idrissa; Brouwer, Marius H.; Noble, Peter A. (1 de março de 2010). «Beyond Affymetrix arrays: expanding the set of known hybridization isotherms and observing pre-wash signal intensities». Nucleic Acids Research. 38 (5): e28. ISSN 0305-1048. PMC 2836560
 . PMID 19969547. doi:10.1093/nar/gkp1122
. PMID 19969547. doi:10.1093/nar/gkp1122
- ↑ Walter, Nicole A. R.; McWeeney, Shannon K.; Peters, Sandra T.; Belknap, John K.; Hitzemann, Robert; Buck, Kari J. (1 de setembro de 2007). «SNPs matter: impact on detection of differential expression». Nature Methods (em inglês). 4 (9): 679–680. ISSN 1548-7091. PMC 3410665
 . PMID 17762873. doi:10.1038/nmeth0907-679
. PMID 17762873. doi:10.1038/nmeth0907-679
- ↑ Walter, Nicole A. R.; Bottomly, Daniel; Laderas, Ted; Mooney, Michael A.; Darakjian, Priscila; Searles, Robert P.; Harrington, Christina A.; McWeeney, Shannon K.; Hitzemann, Robert (1 de janeiro de 2009). «High throughput sequencing in mice: a platform comparison identifies a preponderance of cryptic SNPs». BMC Genomics. 10. 379 páginas. ISSN 1471-2164. PMC 2743714
 . PMID 19686600. doi:10.1186/1471-2164-10-379
. PMID 19686600. doi:10.1186/1471-2164-10-379
- ↑ Sullivan PF; Kendler KS; Neale MC (1 de dezembro de 2003). «Schizophrenia as a complex trait: Evidence from a meta-analysis of twin studies». Archives of General Psychiatry. 60 (12): 1187–1192. ISSN 0003-990X. PMID 14662550. doi:10.1001/archpsyc.60.12.1187

- ↑ Smoller, Jordan W.; Finn, Christine T. (15 de novembro de 2003). «Family, twin, and adoption studies of bipolar disorder». American Journal of Medical Genetics Part C. 123C (1): 48–58. CiteSeerX 10.1.1.456.6790
 . ISSN 1552-4868. PMID 14601036. doi:10.1002/ajmg.c.20013
. ISSN 1552-4868. PMID 14601036. doi:10.1002/ajmg.c.20013
- ↑ Rosenberg, Rebecca E.; Law, J. Kiely; Yenokyan, Gayane; McGready, John; Kaufmann, Walter E.; Law, Paul A. (1 de outubro de 2009). «Characteristics and concordance of autism spectrum disorders among 277 twin pairs». Archives of Pediatrics & Adolescent Medicine. 163 (10): 907–914. ISSN 1538-3628. PMID 19805709. doi:10.1001/archpediatrics.2009.98

- ↑ Frazier, Thomas W.; Thompson, Lee; Youngstrom, Eric A.; Law, Paul; Hardan, Antonio Y.; Eng, Charis; Morris, Nathan (1 de agosto de 2014). «A twin study of heritable and shared environmental contributions to autism». Journal of Autism and Developmental Disorders. 44 (8): 2013–2025. ISSN 1573-3432. PMC 4104233
 . PMID 24604525. doi:10.1007/s10803-014-2081-2
. PMID 24604525. doi:10.1007/s10803-014-2081-2
- ↑ Boomsma, Dorret; Busjahn, Andreas; Peltonen, Leena (1 de novembro de 2002). «Classical twin studies and beyond» (PDF). Nature Reviews Genetics (em inglês). 3 (11): 872–882. ISSN 1471-0056. PMID 12415317. doi:10.1038/nrg932
- ↑ a b c d e Sullivan, Patrick F.; Daly, Mark J.; O'Donovan, Michael (1 de agosto de 2012). «Genetic architectures of psychiatric disorders: the emerging picture and its implications». Nature Reviews Genetics (em inglês). 13 (8): 537–551. ISSN 1471-0056. PMC 4110909
 . PMID 22777127. doi:10.1038/nrg3240
. PMID 22777127. doi:10.1038/nrg3240
- ↑ a b c Johnson, Keith A.; Fox, Nick C.; Sperling, Reisa A.; Klunk, William E. (1 de abril de 2012). «Brain Imaging in Alzheimer Disease». Cold Spring Harbor Perspectives in Medicine. 2 (4): a006213. ISSN 2157-1422. PMC 3312396
 . PMID 22474610. doi:10.1101/cshperspect.a006213
. PMID 22474610. doi:10.1101/cshperspect.a006213
- ↑ McCarroll, Steven A.; Feng, Guoping; Hyman, Steven E. (1 de junho de 2014). «Genome-scale neurogenetics: methodology and meaning». Nature Neuroscience. 17 (6): 756–763. ISSN 1546-1726. PMC 4912829
 . PMID 24866041. doi:10.1038/nn.3716
. PMID 24866041. doi:10.1038/nn.3716
- ↑ a b «Opinion: The Present and Future of Neurogenomics | The Scientist Magazine®». The Scientist. Consultado em 23 de fevereiro de 2016
- ↑ Courchesne, E.; Yeung-Courchesne, R.; Press, G. A.; Hesselink, J. R.; Jernigan, T. L. (26 de maio de 1988). «Hypoplasia of cerebellar vermal lobules VI and VII in autism». The New England Journal of Medicine. 318 (21): 1349–1354. ISSN 0028-4793. PMID 3367935. doi:10.1056/NEJM198805263182102
- ↑ Courchesne, E.; Karns, C. M.; Davis, H. R.; Ziccardi, R.; Carper, R. A.; Tigue, Z. D.; Chisum, H. J.; Moses, P.; Pierce, K. (24 de julho de 2001). «Unusual brain growth patterns in early life in patients with autistic disorder: an MRI study». Neurology. 57 (2): 245–254. ISSN 0028-3878. PMID 11468308. doi:10.1212/wnl.57.2.245
- ↑ Lipska, Barbara K.; Deep-Soboslay, Amy; Weickert, Cynthia Shannon; Hyde, Thomas M.; Martin, Catherine E.; Herman, Mary M.; Kleinman, Joel E. (15 de setembro de 2006). «Critical Factors in Gene Expression in Postmortem Human Brain: Focus on Studies in Schizophrenia». Biological Psychiatry. 60 (6): 650–658. PMID 16997002. doi:10.1016/j.biopsych.2006.06.019
- ↑ Stan, Ana D.; Ghose, Subroto; Gao, Xue-Min; Roberts, Rosalinda C.; Lewis-Amezcua, Kelly; Hatanpaa, Kimmo J.; Tamminga, Carol A. (6 de dezembro de 2006). «Human postmortem tissue: What quality markers matter?». Brain Research. 1123 (1): 1–11. PMC 1995236
 . PMID 17045977. doi:10.1016/j.brainres.2006.09.025
. PMID 17045977. doi:10.1016/j.brainres.2006.09.025
- ↑ Cañestro, Cristian; Postlethwait, John H. (15 de maio de 2007). «Development of a chordate anterior-posterior axis without classical retinoic acid signaling». Developmental Biology. 305 (2): 522–538. ISSN 0012-1606. PMID 17397819. doi:10.1016/j.ydbio.2007.02.032

- ↑ Tallafuss, Alexandra; Trepman, Alissa; Eisen, Judith S. (1 de dezembro de 2009). «DeltaA mRNA and protein distribution in the zebrafish nervous system». Developmental Dynamics. 238 (12): 3226–3236. ISSN 1097-0177. PMC 2882441
 . PMID 19924821. doi:10.1002/dvdy.22136
. PMID 19924821. doi:10.1002/dvdy.22136
- ↑ Russek-Blum, Niva; Gutnick, Amos; Nabel-Rosen, Helit; Blechman, Janna; Staudt, Nicole; Dorsky, Richard I.; Houart, Corinne; Levkowitz, Gil (1 de outubro de 2008). «Dopaminergic neuronal cluster size is determined during early forebrain patterning». Development. 135 (20): 3401–3413. ISSN 0950-1991. PMC 2692842
 . PMID 18799544. doi:10.1242/dev.024232
. PMID 18799544. doi:10.1242/dev.024232
- ↑ Reimer, Michell M.; Sörensen, Inga; Kuscha, Veronika; Frank, Rebecca E.; Liu, Chong; Becker, Catherina G.; Becker, Thomas (20 de agosto de 2008). «Motor neuron regeneration in adult zebrafish». The Journal of Neuroscience. 28 (34): 8510–8516. ISSN 1529-2401. PMC 6671064
 . PMID 18716209. doi:10.1523/JNEUROSCI.1189-08.2008
. PMID 18716209. doi:10.1523/JNEUROSCI.1189-08.2008
- ↑ White, Richard; Rose, Kristin; Zon, Leonard (1 de setembro de 2013). «Zebrafish cancer: the state of the art and the path forward». Nature Reviews Cancer (em inglês). 13 (9): 624–636. ISSN 1474-175X. PMC 6040891
 . PMID 23969693. doi:10.1038/nrc3589
. PMID 23969693. doi:10.1038/nrc3589
- ↑ Darland, T.; Dowling, J. E. (2001). «Behavioral screening for cocaine sensitivity in mutagenized zebrafish». Proc. Natl. Acad. Sci. USA. 98 (20): 11691–11696. Bibcode:2001PNAS...9811691D. PMC 58791
 . PMID 11553778. doi:10.1073/pnas.191380698
. PMID 11553778. doi:10.1073/pnas.191380698
- ↑ Lockwood, B., Bjerke, S., Kobayashi, K. & Guo, S. "Acute effects of alcohol on larval zebrafish
- ↑ Bourgeron, Thomas (1 de setembro de 2015). «From the genetic architecture to synaptic plasticity in autism spectrum disorder». Nature Reviews Neuroscience (em inglês). 16 (9): 551–563. ISSN 1471-003X. PMID 26289574. doi:10.1038/nrn3992
- ↑ Just, Marcel Adam; Cherkassky, Vladimir L.; Keller, Timothy A.; Kana, Rajesh K.; Minshew, Nancy J. (1 de abril de 2007). «Functional and Anatomical Cortical Underconnectivity in Autism: Evidence from an fMRI Study of an Executive Function Task and Corpus Callosum Morphometry». Cerebral Cortex (em inglês). 17 (4): 951–961. ISSN 1047-3211. PMC 4500121
 . PMID 16772313. doi:10.1093/cercor/bhl006
. PMID 16772313. doi:10.1093/cercor/bhl006
- ↑ Oddi, D.; Crusio, W. E.; D’Amato, F. R.; Pietropaolo, S. (15 de agosto de 2013). «Monogenic mouse models of social dysfunction: Implications for autism». Behavioural Brain Research. SI:Neurobiology of Autism. 251: 75–84. PMID 23327738. doi:10.1016/j.bbr.2013.01.002
- ↑ Ramasamy, Adaikalavan; Trabzuni, Daniah; Guelfi, Sebastian; Varghese, Vibin; Smith, Colin; Walker, Robert; De, Tisham; UK Brain Expression Consortium; North American Brain Expression Consortium (1 de outubro de 2014). «Genetic variability in the regulation of gene expression in ten regions of the human brain». Nature Neuroscience (em inglês). 17 (10): 1418–1428. ISSN 1097-6256. PMC 4208299
 . PMID 25174004. doi:10.1038/nn.3801
. PMID 25174004. doi:10.1038/nn.3801
- ↑ Naumova, Oksana Yu.; Lee, Maria; Rychkov, Sergei Yu.; Vlasova, Natalia V.; Grigorenko, Elena L. (1 de janeiro de 2013). «Gene Expression in the Human Brain: The Current State of the Study of Specificity and Spatiotemporal Dynamics». Child Development (em inglês). 84 (1): 76–88. ISSN 1467-8624. PMC 3557706
 . PMID 23145569. doi:10.1111/cdev.12014
. PMID 23145569. doi:10.1111/cdev.12014
- ↑ Carroll, Sean B. (abril de 2003). «Genetics and the making of Homo sapiens». Nature. 422 (6934): 849–857. PMID 12712196. doi:10.1038/nature01495
- ↑ Hill, Robert Sean; Walsh, Christopher A. (1 de setembro de 2005). «Molecular insights into human brain evolution». Nature. 437 (7055): 64–67. Bibcode:2005Natur.437...64H. ISSN 1476-4687. PMID 16136130. doi:10.1038/nature04103
- ↑ a b Rakic, Pasko (1 de outubro de 2009). «Evolution of the neocortex: a perspective from developmental biology». Nature Reviews Neuroscience (em inglês). 10 (10): 724–735. ISSN 1471-003X. PMC 2913577
 . PMID 19763105. doi:10.1038/nrn2719
. PMID 19763105. doi:10.1038/nrn2719
- ↑ Geschwind, Daniel H.; Rakic, Pasko (30 de outubro de 2013). «Cortical evolution: judge the brain by its cover». Neuron. 80 (3): 633–647. ISSN 1097-4199. PMC 3922239
 . PMID 24183016. doi:10.1016/j.neuron.2013.10.045
. PMID 24183016. doi:10.1016/j.neuron.2013.10.045
- ↑ Calarco, John A.; Xing, Yi; Cáceres, Mario; Calarco, Joseph P.; Xiao, Xinshu; Pan, Qun; Lee, Christopher; Preuss, Todd M.; Blencowe, Benjamin J. (15 de novembro de 2007). «Global analysis of alternative splicing differences between humans and chimpanzees». Genes & Development. 21 (22): 2963–2975. ISSN 0890-9369. PMC 2049197
 . PMID 17978102. doi:10.1101/gad.1606907
. PMID 17978102. doi:10.1101/gad.1606907
- ↑ Zhang, Xiao-Ou; Yin, Qing-Fei; Wang, Hai-Bin; Zhang, Yang; Chen, Tian; Zheng, Ping; Lu, Xuhua; Chen, Ling-Ling; Yang, Li (1 de janeiro de 2014). «Species-specific alternative splicing leads to unique expression of sno-lncRNAs». BMC Genomics. 15. 287 páginas. ISSN 1471-2164. PMC 4234469
 . PMID 24734784. doi:10.1186/1471-2164-15-287
. PMID 24734784. doi:10.1186/1471-2164-15-287
- ↑ Somel, Mehmet; Liu, Xiling; Khaitovich, Philipp (1 de fevereiro de 2013). «Human brain evolution: transcripts, metabolites and their regulators». Nature Reviews Neuroscience (em inglês). 14 (2): 112–127. ISSN 1471-003X. PMID 23324662. doi:10.1038/nrn3372
- ↑ Qureshi, Irfan A.; Mehler, Mark F. (1 de agosto de 2012). «Emerging roles of non-coding RNAs in brain evolution, development, plasticity and disease». Nature Reviews Neuroscience (em inglês). 13 (8): 528–541. ISSN 1471-003X. PMC 3478095
 . PMID 22814587. doi:10.1038/nrn3234
. PMID 22814587. doi:10.1038/nrn3234
- ↑ Lee, Phil H.; O'Dushlaine, Colm; Thomas, Brett; Purcell, Shaun M. (1 de julho de 2012). «INRICH: interval-based enrichment analysis for genome-wide association studies». Bioinformatics. 28 (13): 1797–1799. ISSN 1367-4811. PMC 3381960
 . PMID 22513993. doi:10.1093/bioinformatics/bts191
. PMID 22513993. doi:10.1093/bioinformatics/bts191
- ↑ Morris, Andrew P; Voight, Benjamin F; Teslovich, Tanya M; Ferreira, Teresa; Segrè, Ayellet V; Steinthorsdottir, Valgerdur; Strawbridge, Rona J; Khan, Hassan; Grallert, Harald (1 de setembro de 2012). «Large-scale association analysis provides insights into the genetic architecture and pathophysiology of type 2 diabetes». Nature Genetics. 44 (9): 981–990. ISSN 1061-4036. PMC 3442244
 . PMID 22885922. doi:10.1038/ng.2383
. PMID 22885922. doi:10.1038/ng.2383
