Ortocarborano
| Ortocarborano Alerta sobre risco à saúde | |
|---|---|

| |

| |
| Outros nomes | 1,2-Dicarbadodecaborano(12), orto-dicarbadodecaborano |
| Identificadores | |
| Número CAS | |
| ChemSpider | |
| ChEBI | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C2H12B10 |
| Massa molar | 144.23 g mol-1 |
| Aparência | Sólido incolor |
| Ponto de fusão |
320 °C, 593 K, 608 °F |
| Ponto de ebulição |
Decompõe |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Orto-carborano (ou simplesmente Carborano) é o composto organoboro com a fórmula C2B10H12. É o composto do tipo carborano mais proeminente. Este derivado tem sido considerado para uma ampla gama de aplicações, desde polímeros resistentes ao calor até aplicações médicas. É um sólido incolor que funde, sem decomposição, a 320°C.
Estrutura e Ligação[editar | editar código-fonte]

O cluster é uma estrutura de forma icosaédrica relacionada ao íon dodecaborato, B12H122-, porém de carga neutra, com dois boros vizinhos substituídos por dois carbonos. Ele tem, portanto, uma simetria C2v.[1]
As ligações dentro do núcleo do cluster icosaédrico não são ligações covalentes clássicas, e sim uma estrutura de híbrido de ressonância entre ligações covalentes convencionais e ligações de três centros e dois elétrons (também chamadas de ligações tricentradas com 2 elétrons).[2][3] Embora a estrutura possa dar a entender o contrário, com os átomos do cluster aparentemente formando seis ligações, na verdade todos os átomos da gaiola icosaédrica estão de fato realizando quatro ligações (as ligações de três centros são frequentemente representadas por mais de um traço, mas ainda conta como uma única ligação), com todos os átomos de carbono e boro completando os seus octetos; esse tipo de ligação não viola a regra do octeto.
Com 13 pares de elétrons (26 elétrons) deslocalizados na estrutura (provenientes de 3 ligações covalentes comuns e 10 ligações covalentes tricentradas com 2 elétrons misturadas em ressonância), o composto satisfaz a regra de Hückel (4n + 2 elétrons ressonantes) e, portanto, é uma estrutura aromática, o que explica a sua excepcional estabilidade frente a vários outros boranos. [4]
As ligações dos átomos de hidrogênio aos átomos de carbono e boro são ligações covalentes simples comuns.
Preparação[editar | editar código-fonte]
O ortocarborano é preparado pela adição de acetilenos ao decaborano(14) . As sínteses modernas envolvem dois estágios, o primeiro envolvendo a geração de um aduto de decaborano:[5][6]
- B10H14 + 2SEt2 → B10H12(SEt2)2 + H2
Na segunda etapa, o alcino é instalado como fonte de dois vértices de carbono: [6]
- B10H12(SEt2)2 + C2H2 → C2B10H12 + 2SEt2 + H2
Acetilenos substituídos podem ser empregados de forma mais conveniente do que o gás acetileno. Por exemplo, o bis(acetoximetil)acetileno adiciona-se facilmente ao decarborano.
- B10H12(SEt2)2 + C2(CH2O2CCH3)2 → C2B10H10(CH2O2CCH3)2 + 2SEt2 + H2
Os substituintes orgânicos são removidos por hidrólise do éster seguida de oxidação: [5]
- 3 C2B10H10(CH2O2CH3)2 + 10 KOH + + 8 KMnO4 → 3 C2B10H12 + 6 CH3CO2K + 8 MnO2 + 6 K2CO3 + 8 H2O
Reações[editar | editar código-fonte]
Rearranjo térmico[editar | editar código-fonte]
Após aquecimento a 420°C, ele se reorganiza para formar o isômero meta. O isômero para é produzido por aquecimento a temperaturas acima de 600°C.

Redução e "isomerização reversa"[editar | editar código-fonte]
orto-Carborano sofre redução de 2 elétrons quando tratado com uma solução de lítio em amônia líquida. O resultado é o cluster nido [C2B10H12]2-. No diânion, os vértices do carbono não são adjacentes. O mesmo cluster é produzido pela redução do meta-carborano. A oxidação do 7,9[C2B10H12]2- resultante dá orto-carborano. [7]
Desprotonação[editar | editar código-fonte]
O tratamento com reagentes de organolítio dá o derivado de dilítio.[8]
- C2B10H12 + 2BuLi → Li2C2B10H10 + 2BuH
Este composto dilitiado reage com uma variedade de eletrófilos, por exemplo, clorofosfinas, clorosilanos e enxofre. [9]
Degradação por base para Dicarbolídeo[editar | editar código-fonte]
A degradação por base do orto-carborano fornece o derivado aniônico de 11 vértices, precursor dos complexos dicarbolídeo: [10]
Dicarbolídeos (C2B8H112-) funcionam como ligantes para metais de transição e elementos do bloco f. [8] O diânion forma compostos sanduíche, bis(dicarbolídeos). Os dicarbolídeos, sendo fortes doadores de elétrons, estabilizam estados de oxidação mais elevados, por exemplo, Ni(IV).
Desprotonação de carborano[editar | editar código-fonte]
Os vértices CH dos closo -dicarbadodecaboranos sofrem desprotonação após tratamento com reagentes de organolítio : [11]
- C2B10H12 + 2BuLi → Li2C2B10H10 + 2BuH
Esses compostos dilitiados reagem com uma variedade de eletrófilos, por exemplo, clorofosfinas, clorossilanos e enxofre. [12] Muitos dos mesmos compostos podem ser produzidos por hidroboração de alcinos:
O orto-carborano pode ser convertido em carborinos altamente reativos com a fórmula B10C2H10.
Substituição nos vértices de boro[editar | editar código-fonte]
Ao contrário dos hidrogênios nos vértices de carbono, os hidrogênios nos vértices de boro não são ácidos e não reagem com bases fortes. Isso ocorre porque o boro não é tão eletronegativo quanto o carbono e, portanto, a polaridade das ligações B-H é relativamente baixa. A substituição nos vértices do boro ainda é possível utilizando agentes halogenantes através de substituição eletrofílica ou reações fotoquímicas. [13]
Por exemplo, os vértices de boro nas posições 9 e 12 opostas aos vértices de carbono podem ser iodados usando iodo e uma quantidade catalítica de AlCl3 durante um refluxo em diclorometano. [14]

A halogenação exoédrica leva a um aumento no efeito de retirada de elétrons do carborano, o que aumenta a acidez das ligações C-H, especialmente quando os halogênios estão localizados nas posições 9 e 12. [1] A per-halogenação também é possível e ao aumentar o número de átomos de haleto, a capacidade de retrodoação π do haleto diminui, permitindo a formação de ligações intramoleculares haleto-halogeneto não covalentes. [15]

Os derivados iodados do carborano podem ser ainda modificados para acessar produtos alquilados de boro através de uma reação de acoplamento cruzado. Isto pode ser feito tratando o carborano halogenado com um reagente de Grignard na presença de um complexo de fosfina-paládio. Os compostos de bromo e cloro não reagem nas mesmas condições. [16]
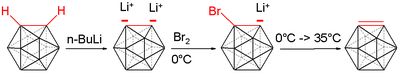
Dimerização do Carborano[editar | editar código-fonte]

Após o tratamento de orto-carboranos com reagentes de organolítio , como o n-butil-lítio, os vértices CH da gaiola de carborano podem ser desprotonados, proporcionando a gaiola de orto-carborano dilitiada. Aproveitando esta ligação carbono-lítio mais ativa, as gaiolas de carborano metaladas podem então ser tratadas com cloreto de cobre(I) enquanto em solventes orgânicos, resultando em uma reação de acoplamento carbono-carbono mediada por cobre das gaiolas de carborano. O sal de cobre é necessário para evitar reações indesejadas de acoplamento carbono-boro e boro-boro. A mistura reacional é deixada agitar à temperatura ambiente durante dois dias, formando uma gaiola de carborano metalado com cobre. Finalmente, a mistura é tratada com ácido clorídrico 3M para extinguir o processo de reação. O produto bruto é então purificado através de cromatografia em coluna e produz um meio equivalente do dímero ligado carbono-carbono do orto-carborano original com rendimentos elevados. Vale a pena notar o efeito da doação de solventes nos rendimentos das reações, uma vez que os rendimentos em solventes como tetra-hidrofurano e éter dietílico proporcionam produtos com rendimentos bastante reduzidos. [17]
História[editar | editar código-fonte]
A preparação de closo-dicarbadodecaboranos foi relatada independentemente por grupos da Olin Corporation e da Reaction Motors Division da Thiokol Chemical Corporation trabalhando sob a Força Aérea dos EUA e publicada em 1963. Esses grupos demonstraram a alta estabilidade no ar do 1,2-closo-dodecaborano e compostos relacionados, apresentaram uma síntese geral, descreveram a transformação de substituintes sem destruir o aglomerado de carborano e demonstraram a isomerização orto para meta. [18]
Ver também[editar | editar código-fonte]
Referências
- ↑ a b Davidson, M. G.; Hibbert, T. G.; Howard, J. A. K.; Mackinnon, A.; Wade, K. (1996). «Definitive crystal structures of ortho-, meta- and para-carboranes: supramolecular structures directed solely by C–H⋯O hydrogen bonding to hmpa (hmpa = hexamethylphosphoramide)». Chem. Commun. (19): 2285–2286. doi:10.1039/CC9960002285
- ↑ «15.4.1: Boranes». Chemistry LibreTexts. 8 de jul. de 2020
- ↑ «Boranes and Borohydrides». Chemistry LibreTexts. 17 de abr. de 2020
- ↑ «Stability patterns in borane cluster chemistry rationalised by extended Hückel molecular orbital studies - ScienceDirect»
- ↑ a b Charles R. Kutal David A. Owen Lee J. Todd (1968). «closo -1,2-Dicarbadodecaborane(12): [ 1,2-Dicarbaclovododecaborane(12 )]». Inorganic Syntheses. 11. [S.l.: s.n.] pp. 19–24. ISBN 978-0-470-13170-1. doi:10.1002/9780470132425.ch5
- ↑ a b M. Frederick Hawthorne; Timothy D. Andrews; Philip M. Garrett; Fred P. Olsen; Marten Reintjes; Fred N. Tebbe; Les F. Warren; Patrick A. Wegner; Donald C. Young (1967). «Icosahedral Carboranes and Intermediates Leading to the Preparation of Carbametallic Boron Hydride Derivatives». Inorganic Syntheses. 10. [S.l.: s.n.] pp. 91–118. ISBN 978-0-470-13241-8. doi:10.1002/9780470132418.ch17
- ↑ Russell N. Grimes (2016). «10. Icosahedral Carboranes: 1,7-C2B10H12 and 1,12-C2B10H12». Carboranes, 3rd Edition. [S.l.]: Elsevier. ISBN 978-0-12-801905-4
- ↑ Popescu, A.-R.; Musteti, A. D.; Ferrer-Ugalde, A.; Viñas, C.; Núñez, R.; Teixidor, F. (2012). «Influential Role of Ethereal Solvent on Organolithium Compounds: The Case of Carboranyllithium». Chemistry – A European Journal. 18 (11): 3174–3184. PMID 22334417. doi:10.1002/chem.201102626
- ↑ Jin, G.-X. (2004). «Advances in the Chemistry of Organometallic Complexes with 1,2-Dichalcogenolato-o-Carborane Ligands». Coord. Chem. Rev. 248 (7–8): 587–602. doi:10.1016/j.ccr.2004.01.002
- ↑ Plešek, J.; Heřmánek, S.; Štíbr, B. (1983). «Potassium dodecahydro-7, 8-dicarba-nido -undecaborate(1-), k[7, 8-c2 b9 h12 ], intermediates, stock solution, and anhydrous salt». Potassium dodecahydro-7,8-dicarba-nido-undecaborate(1-), k[7,8-C2B9H12], intermediates, stock solution, and anhydrous salt. Col: Inorganic Syntheses. 22. [S.l.: s.n.] pp. 231–234. ISBN 978-0-470-13253-1. doi:10.1002/9780470132531.ch53
- ↑ Popescu, A.-R.; Musteti, A. D.; Ferrer-Ugalde, A.; Viñas, C.; Núñez, R.; Teixidor, F. (2012). «Influential Role of Ethereal Solvent on Organolithium Compounds: The Case of Carboranyllithium». Chemistry – A European Journal. 18 (11): 3174–3184. PMID 22334417. doi:10.1002/chem.201102626
- ↑ Jin, G.-X. (2004). «Advances in the Chemistry of Organometallic Complexes with 1,2-Dichalcogenolato-o-Carborane Ligands». Coord. Chem. Rev. 248 (7–8): 587–602. doi:10.1016/j.ccr.2004.01.002
- ↑ Grimes, Russell N. (2016). Carboranes Third ed. Amsterdam Boston Heidelberg: Elsevier, Academic Press. ISBN 978-0-12-801894-1
- ↑ Andrews, John S.; Zayas, Jose; Jones, Maitland (October 1985). «9-Iodo-o-carborane». Inorganic Chemistry (em inglês). 24 (22): 3715–3716. ISSN 0020-1669. doi:10.1021/ic00216a053 Verifique data em:
|data=(ajuda) - ↑ Sivaev, Igor B.; Anufriev, Sergey A.; Shmalko, Akim V. (March 2023). «How substituents at boron atoms affect the CH-acidity and the electron-withdrawing effect of the ortho-carborane cage: A close look on the 1H NMR spectra». Inorganica Chimica Acta (em inglês). 547. 121339 páginas. doi:10.1016/j.ica.2022.121339 Verifique data em:
|data=(ajuda) - ↑ Li, Ji; Logan, Cameron F.; Jones, Maitland (December 1991). «Simple syntheses and alkylation reactions of 3-iodo-o-carborane and 9,12-diiodo-o-carborane». Inorganic Chemistry (em inglês). 30 (25): 4866–4868. ISSN 0020-1669. doi:10.1021/ic00025a037 Verifique data em:
|data=(ajuda) - ↑ Ren, Shikuo; Xie, Zuowei (13 de outubro de 2008). «A Facile and Practical Synthetic Route to 1,1′-Bis( o -carborane)». Organometallics (em inglês). 27 (19): 5167–5168. ISSN 0276-7333. doi:10.1021/om8005323
- ↑ Heying, T. L.; Ager, J. W.; Clark, S. L.; Mangold, D. J.; Goldstein, H. L.; Hillman, M.; Polak, R. J.; Szymanski, J. W. (1963). «A New Series of Organoboranes. I. Carboranes from the Reaction of Decaborane with Acetylenic Compounds». Inorganic Chemistry. 2 (6): 1089–1092. doi:10.1021/ic50010a002