Pentaceno
| Pentaceno Alerta sobre risco à saúde | |
|---|---|

| |
| Identificadores | |
| Número CAS | |
| PubChem | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C22H14 |
| Massa molar | 278.36 g/mol |
| Aparência | Dark powder |
| Densidade | 1.3 g/cm3 |
| Ponto de fusão |
> 300 °C; sublimes at 372 °C |
| Estrutura | |
| Estrutura cristalina | Triclinic |
| Grupo de espaço | P-1 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O pentaceno é um hidrocarboneto aromático policíclico consistindo de cinco anéis de benzeno linearmente fundidos. Este composto altamente conjugado é um semicondutor orgânico. O composto gera excítons sob absorção de luz ultravioleta (UV) ou visível; isto o faz muito sensível a oxidação. Por esta razão, este composto, que é um pó púrpura, degrada-se lentamente após a exposição ao ar e à luz.
Estruturalmente, pentaceno é um dos acenos lineares, o anterior sendo o tetraceno (quatro anéis de benzeno fundidos) e o próximo sendo o hexaceno (seis anéis de benzeno fundidos). Em agosto de 2009, um grupo de pesquisadores da IBM publicou resultados experimentais de produção de imagem de uma única molécula de pentaceno usando um microscópio de força atômica.[1][2] Em julho de 2011, usaram uma modificação do microscópio de corrente de tunelamento para experimentalmente determinar as formas dos orbitais moleculares mais altos ocupados e mais baixos desocupados.[3][4]
Em 2012, p-terfenilo dopado com pentaceno mostrou-se ser efetivo como um meio amplificador para maser operando à temperatura ambiente.[5]
Em fevereiro de 2014, a NASA anunciou um banco de dados altamente atualizado para o rastreamento de hidrocarbonetos aromáticos policíclicos (PAHs, polycyclic aromatic hydrocarbons), incluindo o pentaceno, no universo.[6] De acordo com cientistas, mais de 20% do carbono no universo pode estar associado a PAHs, possíveis materiais de partida para a formação de vida. Os PAHs parecem ter sido formados pouco depois do Big Bang, são difundidos em todo o universo e estão associados a novas estrelas e exoplanetas.[7]
Síntese
[editar | editar código-fonte]

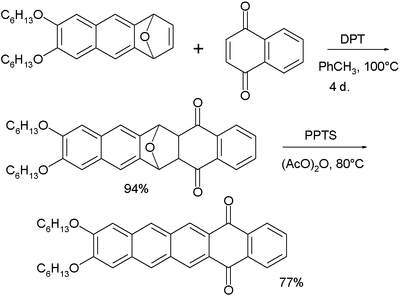
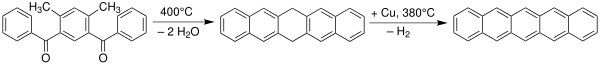
Pentaceno foi primeiramente sintetizado em 1912 pelos químicos britânicos William Hobson Mills e Mildred May Gostling.[9][10] Um método clássico para a síntese de pentaceno é pela reação de Elbs.[11][12]
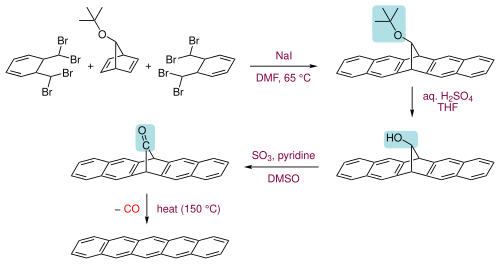
Pentacenos podem também ser preparados por extrusão de um pequeno componente volátil (monóxido de carbono) de um precursor adequado a 150 °C.[13]
O precursor por sua vez é preparado em três etapas a partir do α,α,α',α'-tetrabromo-o-xileno com um 7-tert-butoxibiciclo[2.2.1]hepta-2,5-dieno primeiramente aquecendo com iodeto de sódio em dimetilformamida para formar o sistema em anel, então hidrolisando o grupo tert-butoxi a um álcool e seguido por sua oxidação à cetona.[13] O produto é descrito como tendo alguma solubilidade em clorofórmio e é portanto, passível de ser aplicado em revestimento por rotação. Pentaceno é solúvel em benzenos clorados quentes, tal como 1,2,4-triclorobenzeno, do qual pode ser recristalizado formando plaquetas.
Derivados de pentaceno
[editar | editar código-fonte]Derivados de pentaceno monoméricos
[editar | editar código-fonte]Pentacenos 6,13-substituídos são acessíveis através de pentacenoquinona por reação com um nucleófilo arila ou alquinila (por exemplo reagentes de Grignard ou organolítio) seguido por aromatização redutiva.[14][15][16] Outro método é baseado em homologização de di-inos por metais de transição (através zirconaciclopentadienos) [17][18][19][20][21] Funcionalização de pentaceno tem permitido o controle do empacotamento do estado sólido deste cromóforo.[22][23] A escolha dos substituintes (tanto tamanho como localização da substituição no pentaceno) influencia o empacotamento do estado sólido e pode ser usado para controlar se o composto adota empilhamento pi cofacial 1-dimensional ou 2-dimensional no estado sólido, como oposto ao empacotamento em padrão de espinha de peixe observado para o pentaceno.
Embora a estrutura do pentaceno se assemelhe a de outros compostos aromáticos como antraceno, suas propriedades aromáticas são pobremente definidas; e como tal, o pentaceno e seus derivados são objeto de muita pesquisa.
Um equilíbrio químico tautomérico existe entre 6-metileno-6,13-diidropentaceno e 6-metilpentaceno.
Este equilíbrio é inteiramente a favor do composto metileno. Somente por aquecer-se uma solução do composto a 200 °C produz uma pequena quantidade do pentaceno desenvolvido, como evidenciado pela emergência de uma coloração vermelho-violeta. De acordo com um estudo[24] o mecanismo de reação para este equilíbrio não é baseado em um deslocamento de hidreto 1,5 intramolecular, mas em um radical livre bimolecular hidrogênio migração. Em contraste, isotoluenos com o mesmo centro químico tornam-se facilmente aromatizados.
Pentaceno reage com enxofre elementar em 1,2,4-triclorobenzeno resultando no composto hexatiapentaceno.[25] Cristalografia de raios X mostra que todas os comprimentos de ligação carbono-a-enxofre são aproximadamente iguais (170 pm); disso, segue-se que as estruturas de ressonância B e C com completa separação de carga são mais significativas que a estrutura A.
Na fase de cristal, as moléculas apresentam interações aromáticas de empilhamento, pelo que a distância entre alguns átomos de enxofre nas moléculas da vizinhança moléculas podem tornar-se menores (337 pm) que a soma de dois raios de Van der Waals (180 pm).
Como o relacionado tetratiafulvaleno, este composto é estudado no campo dos semicondutores orgânicos.
Os acenos podem podem apresentar-se como moléculas planares e rígidas, mas na verdade eles podem ser muito distorcidos. O pentaceno descrito abaixo:[26]
tem uma torção de ponta a ponta de 144° e é estericamente estabilizado pelos seis grupos fenila. O composto pode ser resolvido em seus dois enantiômeros com uma relatada rotação óptica excepcionalmente alta de 7400° apesar de racemização tomar lugar com uma meia-vida química de 9 horas.
Oligômeros e polímeros de pentaceno
[editar | editar código-fonte]Oligômeros e polímeros baseados em pentaceno tem sido explorados tanto sinteticamente assim como em configurações em aplicações em dispositivos.[27][28]
Diodos emissores de luz poliméricos (PLEDs, polymer light emitting diodes) tem sido construídos usando-se copolímeros conjugados (1a–b) contendo fluoreno e pentaceno.[29] Uns poucos outros polímeros conjugados de pentaceno (2a–b e 3) tem sido realizado com base em reações de acoplamento Sonogashira e Suzuki de um monômero dibromopentaceno.[30][31] Polímeros baseados em pentaceno não conjugados tem sido sintetizados via esterificação de um monômero diol de pentaceno com cloretos bis-ácido para formar polímeros 4a–b.[32][33]
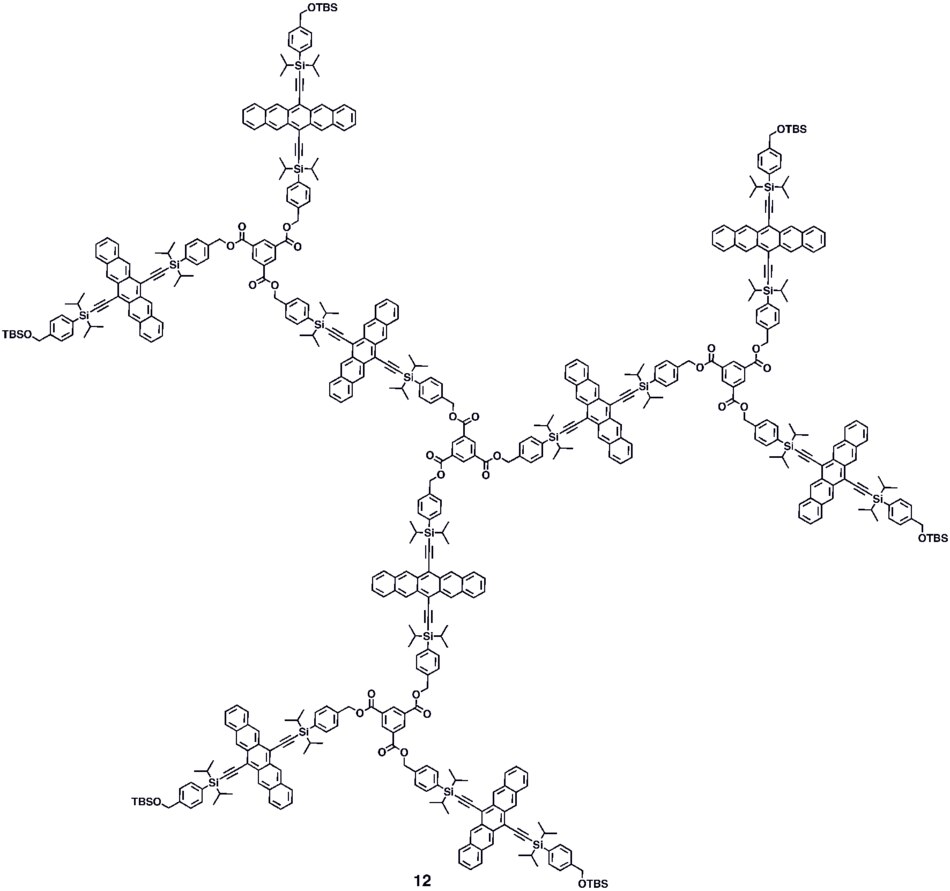
Várias estratégias sintéticas tem sido empregadas para formar oligômeros conjugados de pentaceno 5a–c incluindo um procedimento de formação de um nicho de quatro ligações, o qual fornece um dímero conjugado de pentaceno (5c) processável em solução, o qual exibe ganho fotocondutivo >10,[34] colocando o seu desempenho na mesma ordem de grandeza que os filmes de evaporação térmica de pentaceno não funcionalizado o qual exibe ganho fotocondutivo >16 usando medidas técnicas análogas.[35] Um método sintético modular de pentaceno di-, tri- e tetrâmeros (6–8) conjugados tem sido relatado, o qual é baseado em homo- e reações de intermediários deidropentaceno robustos em acoplamento cruzado.[36] Oligômeros não conjugados 9–10 baseados em pentaceno tem sido sintetizados,[32][33] incluindo dendrímeros 9–10 com até 9 porções moleculares pentaceno por molécula com absorvidade molar para a absorção mais intensa > 2,000,000 M−1•cm−1. Dendrímeros 11–12 mostraram ter melhorado o desempenho em dispositivos em comparação com polímeros análogos baseados em pentaceno 4a–b no contexto de fotodetectores.[37]
Pesquisa de materiais
[editar | editar código-fonte]Pentacenos tem sido pesquisados como potenciais corantes dicróicos. A pentacenoquinona exibida abaixo é fluorescente e quando misturado com mistura E7 de cristal líquido uma razão dicróica de 8 é atingida.[38][nota 1] Acenos mais longos alinham-se melhor na fase nemática de cristal líquido.
Combinado com buckminsterfulereno, pentaceno é usado no desenvolvimento de protótipos fotovoltaicos orgânicos.[39][40] As células fotovoltaicas orgânicas são mais baratas e flexíveis do que as células inorgânicas tradicionais, o que potencialmente pode abrir portas para células solares em novos mercados.[41]
Pentaceno é uma escolha popular em transístores de película fina orgânicos e OFETs, sendo uma das moléculas orgânicas conjugadas mais pesquisadas com um alto potencial de aplicação devido a uma lacuna de mobilidade em OFETs de até 5.5 cm2/(V·s), que excede aquela do silício amorfo.[42][43][44]
Pentaceno, assim como outros condutores orgânicos, está sujeito a rápida oxidação ao ar, o que impede sua comercialização. Se o pentaceno é pré-oxidado, a pentaceno-quinona é um potencial isolador de porta (terminal de um transistor de efeito de campo), então a mobilidade pode aproximar-se aquela do rubreno – o semicondutor orgânico de mais alta mobilidade – nominalmente, 40 cm2/(V·s). Esta técnica de oxidação de pentaceno é semelhante à oxidação de silício usada na eletrônica de silício.[43]
Notas
- ↑ Na síntese deste composto, o material de partida é tratado com 1,4-naftoquinona e DPT. DTP converte o oxo-norbornadieno a um intermediário furano. A segunda etapa é oxidação por PPTS
Referências
- ↑ «Single molecule's stunning image». BBC News. 28 de agosto de 2009. Consultado em 28 de agosto de 2009
- ↑ Gross, L.; Mohn, F; Moll, N; Liljeroth, P; Meyer, G (2009). «The Chemical Structure of a Molecule Resolved by Atomic Force Microscopy». Science. 325 (5944): 1110–1114. Bibcode:2009Sci...325.1110G. PMID 19713523. doi:10.1126/science.1176210
- ↑ Krieger, K. (23 de agosto de 2011). «Molecules Imaged Most Intimately». Science Now. Consultado em 29 de junho de 2017
- ↑ Gross, L.; Moll, N.; Mohn, F.; Curioni, A.; Meyer, G.; Hanke, F.; Persson, M. (2011). «High-Resolution Molecular Orbital Imaging Using a p-Wave STM Tip». Phys. Rev. Lett. 107 (8): 86101–86104. Bibcode:2011PhRvL.107h6101G. PMID 21929180. doi:10.1103/PhysRevLett.107.086101
- ↑ Brumfiel, G. (2012). «Microwave laser fulfills 60 years of promise». Nature. doi:10.1038/nature.2012.11199
- ↑ PAH IR Spectral Database
- ↑ Hoover, Rachel (21 de fevereiro de 2014). «Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That». NASA. Consultado em 22 de fevereiro de 2014
- ↑ Dinca, L. E.; De Marchi, F.; MacLeod, J. M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D. F.; Rosei, F. (2015). «Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene». Nanoscale. 7 (7): 3263–3269. PMID 25619890. doi:10.1039/C4NR07057G
- ↑ Mills, William Hobson; Mills, Mildred (1912). «CCXXX.—The synthetical production of derivatives of dinaphthanthracene». J. Chem. Soc., Trans. 101: 2194–2208. doi:10.1039/CT9120102194
- ↑ Chung, Hyunjoong; Diao, Ying (2016). «Polymorphism as an emerging design strategy for high performance organic electronics». J. Mater. Chem. C. 4 (18): 3915–3933. doi:10.1039/C5TC04390E.
Since its synthesis in 1912 to the categorization of at least four different polymorphs in 2003, pentacene has developed into a benchmark organic semiconductor due to its excellent thin film transistor performance. (Tradução: Desde a sua síntese em 1912 para a categorização de pelo menos quatro polimorfos diferentes em 2003, o pentaceno desenvolveu-se como um semicondutor orgânico de referência devido ao excelente desempenho do transistor de filme fino.) )
- ↑ Elbs, Karl (1886). «Beiträge zur Kenntniss aromatischer Ketone. Erste Mittheilung». J. Prakt. Chem. (em alemão). 33 (1): 180–188. doi:10.1002/prac.18860330119
- ↑ Breitmaier, Eberhard; Jung, Günther (2005). «12.5.3 Elbs-Reaktion». Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstrukturen (em alemão) 5th ed. Stuttgart: Georg Thieme Verlag. p. 183. ISBN 9783135415055
- ↑ a b Chen, Kew-Yu; Hsieh, Hsing-Hung; Wu, Chung-Chih; Hwang, Jiunn-Jye; Chow, Tahsin J. (2007). «A new type of soluble pentacene precursor for organic thin-film transistors». Chem. Commun. 2007 (10): 1065–1067. PMID 17325807. doi:10.1039/b616511g
- ↑ Allen, C. F. H.; Bell, Alan (1942). «Action of Grignard Reagents on Certain Pentacenequinones, 6,13-Diphenylpentacene». Journal of the American Chemical Society. 64 (6): 1253–1260. doi:10.1021/ja01258a005
- ↑ Maulding, D. R.; Roberts, Bernard G. (1969). «Electronic absorption and fluorescence of phenylethynyl-substituted acenes». The Journal of Organic Chemistry. 34 (6): 1734–1736. doi:10.1021/jo01258a045
- ↑ Li, Shi; Zhou, Lishan; Nakajima, Kiyohiko; Kanno, Ken-Ichiro; Takahashi, Tamotsu (2010). «Synthesis of 1,2,3,4,8,9,10,11-Octasubstituted Pentacenequinone Derivatives and their Conversion into Substituted Pentacenes». Chemistry: An Asian Journal. 5 (7): 1620–6. PMID 20455241. doi:10.1002/asia.200900754
- ↑ Takahashi, Tamotsu; Kitamura, Masanori; Shen, Baojian; Nakajima, Kiyohiko (2000). «Straightforward Method for Synthesis of Highly Alkyl-Substituted Naphthacene and Pentacene Derivatives by Homologation». Journal of the American Chemical Society. 122 (51): 12876–12877. doi:10.1021/ja003130g
- ↑ Takahashi, Tamotsu; Li, Shi; Huang, Wenying; Kong, Fanzhi; Nakajima, Kiyohiko; Shen, Baojian; Ohe, Takahiro; Kanno, Ken-Ichiro (2006). «Homologation Method for Preparation of Substituted Pentacenes and Naphthacenes». The Journal of Organic Chemistry. 71 (21): 7967–77. PMID 17025283. doi:10.1021/jo060923y
- ↑ Takahashi, Tamotsu; Li, Yanzhong; Hu, Jinghan; Kong, Fanzhi; Nakajima, Kiyohiko; Zhou, Lishan; Kanno, Ken-Ichiro (2007). «Cu(I)-mediated cycloaddition reaction of zirconacyclopentadienes with fumaronitrile and application for synthesis of monocyano-substituted pentacenes». Tetrahedron Letters. 48 (38): 6726–6730. doi:10.1016/j.tetlet.2007.07.075
- ↑ Stone, Matthew T.; Anderson, Harry L. (2007). «Three-Step Synthesis of End-Substituted Pentacenes». The Journal of Organic Chemistry. 72 (25): 9776–8. PMID 17999529. doi:10.1021/jo7017284
- ↑ Li, Shi; Li, Zhiping; Nakajima, Kiyohiko; Kanno, Ken-Ichiro; Takahashi, Tamotsu (2009). «Double Homologation Method for Substituted Soluble Pentacenes and Dimerization Behaviours of Pentacenes». Chemistry: An Asian Journal. 4 (2): 294–301. PMID 19072938. doi:10.1002/asia.200800312
- ↑ Anthony, J. E.; Brooks, J. S.; Eaton, D. L.; Parkin, S. R. (2001). «Functionalized Pentacene: Improved Electronic Properties from Control of Solid-State Order». Journal of the American Chemical Society. 123 (38): 9482–9483. PMID 11562247. doi:10.1021/ja0162459
- ↑ Anthony, J. E.; Eaton, D. L.; Parkin, S. R. (2002). «A Road Map to Stable, Soluble, Easily Crystallized Pentacene Derivatives». Organic Letters. 4 (1): 15–18. PMID 11772079. doi:10.1021/ol0167356
- ↑ Norton, Joseph E.; Northrop, BH; Nuckolls, C; Houk, KN (2006). «Why 6-Methylpentacene Deconjugates but Avoids the Thermally Allowed Unimolecular Mechanism». Organic Letters. 8 (21): 4915–8. PMID 17020335. doi:10.1021/ol062012g
- ↑ Briseno, Alejandro L.; Miao, Q; Ling, MM; Reese, C; Meng, H; Bao, Z; Wudl, F (2006). «Hexathiapentacene: Structure, Molecular Packing, and Thin-Film Transistors». Journal of the American Chemical Society. 128 (49): 15576–7. PMID 17147352. doi:10.1021/ja066088j.
- ↑ Lu, Jun; Ho, DM; Vogelaar, NJ; Kraml, CM; Bernhard, S; Byrne, N; Kim, LR; Pascal Jr, RA (2006). «Synthesis, Structure, and Resolution of Exceptionally Twisted Pentacenes». Journal of the American Chemical Society. 128 (51): 17043–50. PMID 17177456. doi:10.1021/ja065935f
- ↑ Lehnherr, D.; Tykwinski, R.R. (2010). «Oligomers and Polymers Based on Pentacene Building Blocks». Materials. 3 (4): 2772–2800. Bibcode:2010Mate....3.2772L. doi:10.3390/ma3042772
- ↑ Lehnherr, D.; Tykwinski, R. R. (2011). «Conjugated Oligomers and Polymers Based on Anthracene, Tetracene, Pentacene, Naphthodithiophene, and Anthradithiophene Building Blocks». Australian Journal of Chemistry. 64 (7): 919–929. doi:10.1071/CH11169
- ↑ Tokito, S.; Weinfurtner, K.-H.; Fujikawa, H.; Tsutsui, T.; Taga, Y. (2001). «Acene containing polyfluorenes for red, green and blue emission in organic light-emitting diodes». Proc. SPIE–Int. Opt. Soc. Eng. Organic Light-Emitting Materials and Devices IV. 4105: 69–74. doi:10.1117/12.416877
- ↑ Okamoto, T.; Bao, Z. (2007). «Synthesis of solution-soluble pentacene-containing conjugated copolymers». Journal of the American Chemical Society. 129 (34): 10308–10309. PMID 17685520. doi:10.1021/ja0725403
- ↑ Okamoto, T.; Okamoto, T.; Jiang, Y.; Qu, F.; Mayer, A.C.; Parmer, J.E.; McGehee, M.D.; Bao, Z. (2008). «Synthesis and characterization of pentacene– and anthradithiophene–fluorene conjugated copolymers synthesized by Suzuki reactions». Macromolecules. 41 (19): 6977–6980. Bibcode:2008MaMol..41.6977O. doi:10.1021/ma800931a
- ↑ a b Lehnherr, D.; Tykwinski, R. R. (2007). «Pentacene Oligomers and Polymers: Functionalization of Pentacene to Afford Mono-, Di-, Tri-, and Polymeric Materials». Organic Letters. 9 (22): 4583–4586. PMID 17918951. doi:10.1021/ol702094d
- ↑ a b Lehnherr, Dan; McDonald, Robert; Ferguson, Michael J.; Tykwinski, Rik R. (2008). «Synthesis of soluble oligo- and polymeric pentacene-based materials». Tetrahedron. 64 (50): 11449–11461. ISSN 0040-4020. doi:10.1016/j.tet.2008.09.041
- ↑ Lehnherr, D.; Gao, J.; Hegmann, F. A.; Tykwinski, R. R. (2008). «Synthesis and Electronic Properties of Conjugated Pentacene Dimers». Organic Letters. 10 (21): 4779–4782. PMID 18823120. doi:10.1021/ol801886h
- ↑ Gao, J.; Hegmann, F. A (2008). «Bulk photoconductive gain in pentacene thin films». Applied Physics Letters. 93 (22). 223306 páginas. Bibcode:2008ApPhL..93v3306G. doi:10.1063/1.3043431
- ↑ Lehnherr, D.; Murray, A. H.; McDonald, R.; Tykwinski, R.R. (2010). «A Modular Synthetic Approach to Conjugated Pentacene Di-, Tri-, and Tetramers». Angewandte Chemie International Edition. 49 (35): 6190–6194. PMID 20645363. doi:10.1002/anie.201000555
- ↑ Lehnherr, D.; Gao, J.; Hegmann, F. A.; Tykwinski, R. R. (2009). «Pentacene-based dendrimers: synthesis and thin film photoconductivity measurements of branched pentacene oligomers». Journal of Organic Chemistry. 74 (14): 5017–5024. PMID 19489566. doi:10.1021/jo9007089
- ↑ Chen, Zhihua; Swager, TM (2007). «Synthesis and Characterization of Fluorescent Acenequinones as Dyes for Guest−Host Liquid Crystal Displays». Organic Letters. 9 (6): 997–1000. PMID 17298074. doi:10.1021/ol062999m
- ↑ Dissanayake, D. M. Nanditha M. (2007). «Nanoimprinted large area heterojunction pentacene-C[sub 60] photovoltaic device». Applied Physics Letters. 90 (25). 253502 páginas. Bibcode:2007ApPhL..90y3502D. doi:10.1063/1.2749863
- ↑ Efficiently Organic: Researchers Use Pentacene To Develop Next-generation Solar Power sciencedaily.com Link
- ↑ «Efficiently Organic: Researchers Use Pentacene To Develop Next-generation Solar Power». ScienceDaily (em inglês). Consultado em 14 de novembro de 2017
- ↑ Norbert Koch (2007). «Organic Electronic Devices and Their Functional Interfaces». ChemPhysChem. 8 (10): 1438–55. PMID 17539032. doi:10.1002/cphc.200700177
- ↑ a b Tatsuo Hasegawa & Jun Takeya (2009). «Organic field-effect transistors using single crystals». Sci. Technol. Adv. Mater. 10 (2): 024314. Bibcode:2009STAdM..10b4314H. doi:10.1088/1468-6996/10/2/024314
- ↑ Yoshiro Yamashita (2009). «Organic semiconductors for organic field-effect transistors». Sci. Technol. Adv. Mater. 10 (2): 024313. Bibcode:2009STAdM..10b4313Y. doi:10.1088/1468-6996/10/2/024313
Ligações externas
[editar | editar código-fonte]- Folha: Pela primeira vez, cientistas "fotografam" molécula individual
- Fabio Pichierri; facts about pentacene Pentacene; Tohoku University; Sendai, Japan; Molecule of the Month - November 2006.
- Organic transistor improves with age, New Scientist, 2 December 2007
- Pentacene Imaged, IBM images Pentacene, the first molecule imaged in detail 29 August 2009