Vanadato

Em química, um vanadato é um complexo de coordenação aniônico de vanádio. Frequentemente, vanadato se refere a oxoânions de vanádio, a maioria dos quais existe em seu estado de oxidação mais alto de +5. Um íon vanadato simples é o ânion ortovanadato tetraédrico, VO3–
4
(que também é chamado de vanadato (V)), que está presente, por exemplo, no ortovanadato de sódio e em soluções de V
2O
5 em base forte (pH > 13 [1]). Convencionalmente, esse íon é representado com uma única ligação dupla; no entanto, esta é uma forma de ressonância, pois o íon é um tetraedro regular com quatro átomos de oxigênio equivalentes.
Além disso, existe uma gama de íons polioxovanadatos que incluem íons discretos e íons poliméricos "infinitos".[2] Existem também vanadatos, como o vanadato de ródio, RhVO
4, que tem uma estrutura estatística de rutilo onde os íons Rh3+ e V5+ ocupam aleatoriamente as posições Ti4+ na rede de rutilo,[3] que não contêm uma rede de cátions e ânions vanadatos de equilíbrio, mas são óxidos mistos.
Exemplos de íons oxovanadato
[editar | editar código-fonte]
O elemento vanádio é conhecido por formar uma rica química de oxoânions em estado sólido e em solução, formando desde oxoânions simples até polioxometalatos com estruturas complexas. Alguns exemplos incluem:
- VO3–
4, o íon simples ortovanadato tetraédrico, análogo ao fosfato;[4] - V
2O4–
7, íon divanadato ou pirovanadato, análogo ao pirofosfato e dicromato. É composto por dois tetraedros VO
4 compartilhando um vértice;[5] - V
3O3–
9, um anel de seis membros de tetraedros VO
4 compartilhando 2 vértices;[6] - V
4O4–
12, um anel de oito membros.[7] - V
5O3–
14, anel bicíclico de tetraedros VO
4 compartilhando 2 ou 3 vértices.[8] - V
6O6–
18, anel de 12 membros.[9] - V
10O6–
28, decavanadato, um polioxometalato com estrutura complexa formado por octaedros VO
6 compartilhando arestas e vértices.[10] - V
12O4–
32, um polioxometalato formado por octaedros fundidos. - V
13O3–
34, polioxometalato formado por octaedros fundidos. - V
18O12–
42, polioxometalato formado por octaedros fundidos.
Há também espécies poliméricas de vanadatos:
- (VO–
3)n, íon metavanadato, formado por uma cadeia “infinita” de tetraedros VO
4 encadeados, compartilhando dois vértices.[11] - (V
3O–
8)n, um polímero baseado no ânion V
3O3–
9[12]
 |
 |
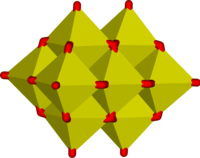 |
Cadeia polimérica do íon metavanadato, VO–
3 |
V
5O3– 14 |
Íon decavanadato, V
10O6– 28 |
Nestes íons, o vanádio exibe coordenação tetraédrica, piramidal quadrada e octaédrica. Neste aspecto, o vanádio mostra similaridades com o tungstato e o molibdato, enquanto o cromo, no entanto, tem uma gama mais limitada de íons.
Síntese
[editar | editar código-fonte]

Sais de vanadato podem ser produzidos a partir da reação do pentóxido de vanádio com uma base.[13] V
2O
5 é um óxido anfótero (embora seja preponderantemente ácido), dissolvendo-se tanto em soluções de ácidos quanto de bases.[14] Em meio básico forte, o V
2O
5 laranja se dissolve dando uma solução de ortovanadato incolor:
- V
2O
5 + 6NaOH —> Na
3VO
4 + 3H
2O
Ortovanadato também pode ser obtidos a partir da reação de sais catiônicos de vanádio +5 com bases fortes:
- VOCl
3 + 6NaOH —> Na
3VO
4 + 3NaCl + 3H
2O - VO+
2NO–
3 + 4KOH —> K
3VO
4 + KNO
3 + 2H
2O
Também podem ser formados pelo tratamento de um composto de vanádio em estado de oxidação mais baixo com um oxidante adequado em meio básico:
- 2VO2+SO2–
4 + 12NaOH + Cl
2 —> 2Na
3VO
4 + 2Na
2SO
4 + 2NaCl + 2H
2O
- 2VCl
3 + 12KOH + O
2 —> 2K
3VO
4 + 6KCl + 6H
2O
Vanadatos de estruturas mais complexas podem ser obtidos a partir da acidulação cuidadosa de soluções de ortovanadato. O homopoliânion decavanadato, V
10O6–
28, um ânion distinto por sua cor laranja intensa em solução,[15] é um dos polivanadatos mais estáveis em soluções aquosas.[16]
- 10VO3–
4 + 24H+ —> [V
10O
28]6– + 12H
2O
O íon decavanadato também pode ser produzido tratando-se V
2O
5 com solução de amônia e deixando a solução em repouso por algumas horas. A solução a princípio incolor torna-se laranja devido à presença do sal decavanadato de amônio.[carece de fontes]
- 5V
2O
5 + 6NH
4OH —> (NH
4)
6[V
10O
28] + 3H
2O
Reações
[editar | editar código-fonte]
Quando tratados com ácidos fortes, os vanadatos são protonados e precipitam na forma de flocos de pentóxido de vanádio hidratado alaranjado por volta do pH 2. Em pH mais baixo, o precipitado redissolve com a formação de sais de pervanadila.
- 2VO3–
4 + 6H+ —> V
2O
5 + 3H
2O - V
2O
5 + 2H+ —> 2VO+
2 + H
2O
O tratamento cuidadoso de soluções de ortovanadato com ácido produz polivanadatos de estruturas mais complexas,[17] como os metavanadatos poliméricos e os decavanadatos:
- nNa
3VO
4 + 2nH+ —> nNaH
2VO
4 + 2nNa+ —> (NaVO
3)n + 2nNa+ + nH
2O
- 10VO3–
4 + 24H+ —> [V
10O
28]6– + 12H
2O
Os vanadatos reagem com o peróxido de hidrogênio formando uma solução amarela contendo o peroxocomplexo aniônico tetraperoxovanadato(V). O tratamento dessa solução com ácidos leva a um produto de cor vermelha, o qual é um peroxocomplexo catiônico.
- Na
3VO
4 + 4H
2O
2 —> Na
3[V(O
2)
4] + 4H
2O - Na
3[V(O
2)
4] + 4HCl + 4H
2O —> [VO(O
2)(H
2O)
3]Cl + 3NaCl + 3H
2O
2
Hipovanadatos
[editar | editar código-fonte]Hipovanadatos, algumas vezes chamados vanaditos, são ânions oxigenados de vanádio em seu estado de oxidação +4, diferente dos vanadatos que são oxoânions de vanádio no estado +5. São formados quando o dióxido de vanádio (VO
2) ou algum sal de vanádio tetravalente são tratados com bases fortes.[18] Hipovanadatos são ânions de cor marrom-amarelada e fortemente redutores, sendo facilmente oxidados pelo ar para vanadatos.
Quando compostos de vanádio (IV) são tratados com soluções moderadamente básicas, o ânion tetramérico V
4O2–
9 é formado:
- 4VO
2 + 2NaOH —> Na
2[V
4O
9] + H
2O
- 4VO2+ + 10NaOH —> Na
2[V
4O
9] + 5H
2O
Em pH básico muito forte, por volta de 13 a 14, o ânion simples tetraédrico orto-hipovanadato é formado:
- VO
2 + 4OH– —> VO4–
4 + 2H
2O
Pervanadatos
[editar | editar código-fonte]Quando soluções básicas de vanadatos são tratadas com peróxido de hidrogênio, sais do complexo peróxido aniônico peroxovanadato(V) de cor amarela intensa[19] [V(O
2)
4]3– (também conhecido como pervanadato) são formados. Esse peroxocomplexo lentamente se decompõe em água para formar vanadato e gás oxigênio.
- Na
3VO
4 + 4H
2O
2 —> Na
3[V(O
2)
4] + 4H
2O
Complexos não-oxoânions com o nome “vanadato”
[editar | editar código-fonte]Na nomenclatura da química de coordenação, quando o termo "vanadato" faz parte do nome do composto, isso indica que o mesmo contém um ânion complexo com um átomo de vanádio central, não necessariamente ligado ao oxigênio ou no estado de oxidação +5. Por exemplo, o composto químico (NH
4)
3[VF
6], sem oxigênio e no estado +3, é nomeado como hexafluorovanadato(III) de amônio.
De forma semelhante, os complexos [V(CN)
6]3– e [VO(C
2O
4)
2]2– são chamados de hexacianovanadato(III) e oxobis(oxalato)vanadato(IV), respectivamente.
Soluções aquosas
[editar | editar código-fonte]A dissolução do pentóxido de vanádio em solução aquosa fortemente básica produz o íon incolor ortovanadato, VO3–
4. Na acidificação, a cor desta solução escurece gradualmente através do laranja para o vermelho em torno do pH 7. O V
2O
5 hidratado laranja-marrom precipita em torno do pH 2, redissolvendo-se em pH mais baixo para formar uma solução amarelo claro contendo o íon pervanadila, [VO
2(H
2O)
4]+. O número e a identidade dos oxoânions que existem entre pH 13 e 2 dependem do pH, bem como da concentração. Por exemplo, a protonação do vanadato inicia uma série de condensações para produzir íons polioxovanadato:[20]
- pH 9–12: HVO2–
4, V
2O4–
7 - pH 4–9: H
2VO–
4, V
4O4–
12, HV
10O5–
28 - pH 2–4: H
3VO
4, H
2V
10O4–
28
Aplicações
[editar | editar código-fonte]Alguns ortovanadatos têm sido utilizados por suas características ópticas e, em particular, luminescentes por um longo tempo, e estão presentes em aplicações importantes como fósforos, cintiladores de raios X e raios gama, materiais catodoluminescentes , termofósforos, materiais hospedeiros de laser e polarizadores ópticos.
O ortovanadato de ítrio, YVO
4, é um material muito utilizado em dispositivos ópticos. É um cristal incolor usado para fazer prismas polarizadores eficientes de alta potência, semelhantes aos prismas de Glan-Taylor.[21] Quando dopado com európio, é utilizado para produzir materiais fluorescentes emissores de luz vermelha, como os fosfóreos de monitores CRT.[22] Dopado com neodímio, é usado como um meio laser ativo usado em lasers de estado sólido bombeados por diodo.[23]
O ortovanadato de bismuto BiVO
4 é um composto amarelo vivo que tem sido empregado na produção de pigmentos amarelos para tintas, em substituição ao altamente tóxico cromato de chumbo, anteriormente usado para esse fim. Esse composto também encontra uso como um fotocatalisador.[24]
Ocorrência natural
[editar | editar código-fonte]O íon ortovanadato é isoestrutural ao íon fosfato, e partilha com ele várias propriedades em comum.[25] De forma que esse íon pode substituir o fosfato em alguns de seus minerais (substituição isomórfica). Um importante mineral fonte de vanádio é a vanadinita, um sal duplo de ortovanadato-cloreto de chumbo Pb
5(VO
4)
3Cl. Outro mineral importante de vanadato é a carnotita, KUO
2VO
4 • 3/
2 H
2O, um importante minério de urânio e vanádio.
O vanádio é o segundo metal de transição mais abundante em solução nas águas do mar aberto, perdendo em abundância apenas para o molibdênio.[26] Ele está presente principalmente na forma dos íons vanadila (VO2+)[27] e dihidrogeno-ortovanadato (H
2VO–
4).[28]
Propriedades farmacológicas
[editar | editar código-fonte]O vanadato é um inibidor potente de certas ATPases da membrana plasmática, como a Na+ /K+-ATPase e a Ca2+-ATPase (PMCA). Atuando como um análogo de estado de transição do fosfato, o vanadato sofre ataque nucleofílico pela água durante a transferência de fosforila, essencialmente "aprisionando" as ATPases do tipo P em seu estado E2 fosforilado.[29][30] Ele também inibe a atividade da actomiosina MgATPase do músculo esquelético[31] e a geração de força ativada pelo cálcio pela actomiosina no aparelho contrátil do músculo esquelético intacto.[32] No entanto, ele não inibe outras ATPases, como a SERCA (Ca2+ -ATPase do retículo sarco/endoplasmático) ou a ATPase mitocondrial.[33][34][35]
Referências
- ↑ Predefinição:Cotton&Wilkinson6th
- ↑ Verevkin, A.; Pearlman, A.; Slstrokysz, W.; Zhang, J.; Currie, M.; Korneev, A.; Chulkova, G.; Okunev, O.; Kouminov, P.; Smirnov, K.; Voronov, B.; N. Gol'tsman, G.; Sobolewski, Roman (2004). "Ultrafast superconducting single-photon detectors for near-infrared-wavelength quantum communications". Journal of Modern Optics 51 (12): 1447–1458. doi:10.1080/09500340410001670866.
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Greenwood, Norman N .; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ↑ Greenwood, Norman N .; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ↑ Hamilton EE; Fanwick PE; Wilker JJ (2002). "O elusivo vanadato (V 3 O 9 ) 3− : isolamento, estrutura cristalina e comportamento de solução não úmida" . J. Sou. Soc. 124 (1): 78–82. doi : 10.1021/ja010820r . PMID11772064 .
- ↑ G.-Y. Yang, D.-W. Gao, Y. Chen, J.-Q. Xu, Q.-X. Zeng, H.-R. Sun, Z.-W. Pei, Q. Su, Y. Xing, Y.-H. Ling e H.-Q. Jia (1998). "[Ni( C10H8N2 ) 3 ] 2 [ V4O12 ] · 11H2O " . Acta Crystallographica C. 54 ( 5): 616–618. Bibcode : 1998AcCrC..54..616Y . doi : 10.1107 / S0108270197018751 .
- ↑ VW Day; Walter G. Klemperer ; OM Yaghi (1989). "Um novo tipo de estrutura na química de polioxoanions: síntese e estrutura do V 5O3-14 ânion". J. Am. Chem. Soc. 111 (12): 4518. doi : 10.1021/ja00194a068 .
- ↑ Guang-Chuan Ou.; Tong-Bu Lu (2009). "Complexos de metais macrocíclicos com pontes de polioxoânion de vanádio: de estruturas unidimensionais a tridimensionais". Dalton Transactions . 1 (1): 71–76. doi : 10.1039/B810802A . PMID 19081973 . S2CID 35209358 .
- ↑ Greenwood, Norman N .; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ↑ Greenwood, Norman N .; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ↑ Fechar [ 10 ] Jouanneau, S.; Guyomard, D. (2003). "Sobre um novo vanadato de cálcio: síntese, estrutura e comportamento de inserção de Li". Journal of Solid State Chemistry . 172 (1): 116–122. Bibcode : 2003JSSCh.172..116J . doi : 10.1016/S0022-4596(02)00164-0 .
- ↑ Greenwood, Norman N. ; Earnshaw, Alan (1984). Química dos Elementos . Oxford: Pergamon Press . pp. 1140, 1144. ISBN 978-0-08-022057-4. .
- ↑ https://chemistry.stackexchange.com/questions/181700/amphoteric-character-of-v2o5
- ↑ Johnson, G.; Murmann, R. K.; Deavin, R.; Griffith, W. P. (2007). «Sodium and Ammonium Decavanadates». Inorganic Syntheses. 19: 140–145. doi:10.1002/9780470132500.ch32
- ↑ Tracey, AS; Crans, DC (1998). Compostos de vanádio . Washington DC: Sociedade Química Americana. ISBN 0-8412-3589-9.
- ↑ Greenwood, Norman N .; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ↑ https://www.britannica.com/science/vanadium-oxide
- ↑ https://inis.iaea.org/search/search.aspx?orig_q=RN:19007747
- ↑ Greenwood, Norman N .; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ↑ patent
- ↑ Caro, Paul (1 de junho de 1998). «Rare earths in luminescence». Rare earths. [S.l.]: Editorial Complutense. pp. 323–325. ISBN 978-84-89784-33-8
- ↑ Koechner, Walter (2006). «Nd:YVO4». Solid-state laser engineering. [S.l.]: Springer. 69 páginas. ISBN 978-0-387-29094-2
- ↑ https://www.chembk.com/en/chem/Bismuth%20orthovanadate
- ↑ https://www.sciencedirect.com/science/article/pii/S0021925819811894
- ↑ https://www.sciencedirect.com/science/article/pii/S0021925819811894
- ↑ Rehder, Dieter (2008). Química bioinorgânica do vanádio . Química inorgânica (1ª ed.). Hamburgo, Alemanha: John Wiley & Sons, Ltd. pp. 5 e 9–10. doi : 10.1002/9780470994429 . ISBN 9780470065099.
- ↑ https://www.sciencedirect.com/science/article/abs/pii/S0020169316309409
- ↑ Kühlbrandt, Werner (April 2004). «Biology, structure and mechanism of P-type ATPases». Nature Reviews. Molecular Cell Biology. 5 (4): 282–295. ISSN 1471-0072. PMID 15071553. doi:10.1038/nrm1354 Verifique data em:
|data=(ajuda) - ↑ Davies, Douglas R.; Hol, Wim G.J. (19 de novembro de 2004). «The power of vanadate in crystallographic investigations of phosphoryl transfer enzymes». FEBS Letters (em inglês). 577 (3): 315–321. ISSN 0014-5793. PMID 15556602. doi:10.1016/j.febslet.2004.10.022

- ↑ Goodno, C.C.; Taylor, E.W. (1982). «Inhibition of actomyosin ATPase by vanadate». Proceedings of the National Academy of Sciences USA. 79 (1): 21–25. Bibcode:1982PNAS...79...21G. PMC 345653
 . PMID 6459580. doi:10.1073/pnas.79.1.21
. PMID 6459580. doi:10.1073/pnas.79.1.21
- ↑ Wilson, G.J.; Shull, S.E.; Cooke, R. (1995). «Inhibition of muscle force by vanadate». Biophysical Journal. 68 (1): 216–226. Bibcode:1995BpJ....68..216W. PMC 1281679
 . PMID 7711244. doi:10.1016/S0006-3495(95)80177-3
. PMID 7711244. doi:10.1016/S0006-3495(95)80177-3
- ↑ Luo D.; Nakazawa M.; Yoshida Y.; Cai J.; Imai S. (2000). «Effects of three different Ca2+ pump ATPase inhibitors on evoked contractions in rabbit aorta and activities of Ca2+ pump ATPases in porcine aorta». General Pharmacology: The Vascular System. 34 (3): 211–220. PMID 11120383. doi:10.1016/S0306-3623(00)00064-1
- ↑ Bowman B.J.; Slayman C.W. (1979). «The Effects of Vanadate on the Plasma Membrane ATPase of Neurospora crassa». Journal of Biological Chemistry. 254 (8): 2928–2934. PMID 155060. doi:10.1016/S0021-9258(17)30163-1

- ↑ Aureliano, Manuel; Crans, Debbie C. (2009). «Decavanadate ( V10O6−
28) and oxovanadates: Oxometalates with many biological activities». Journal of Inorganic Biochemistry. 103 (4): 536–546. ISSN 0162-0134. PMID 19110314. doi:10.1016/j.jinorgbio.2008.11.010 line feed character character in|title=at position 15 (ajuda)
