Anestésico geral
Os anestésicos gerais (ou anestésicos) são geralmente definidos como compostos que induzem a perda de consciência em humanos ou a perda do reflexo de endireitamento [en] em animais. As definições clínicas também são estendidas para incluir um coma induzido que causa falta de consciência aos estímulos dolorosos, o suficiente para facilitar as aplicações cirúrgicas na prática clínica e veterinária. Os anestésicos gerais não agem como analgésicos e também não devem ser confundidos com sedativos. Os anestésicos gerais são um grupo estruturalmente diverso de compostos cujos mecanismos abrangem vários alvos biológicos envolvidos no controle das vias neuronais. O funcionamento preciso é objeto de debate e de pesquisas em andamento.[1]
Os anestésicos gerais provocam um estado de anestesia geral. Ainda há certa controvérsia sobre como esse estado deve ser definido.[2] Os anestésicos gerais, no entanto, normalmente provocam vários efeitos reversíveis importantes: imobilidade, analgesia, amnésia, inconsciência e redução da resposta autonômica a estímulos nocivos.[2][3][4]
Modo de administração
[editar | editar código-fonte]Os anestésicos gerais podem ser administrados como gases ou vapores (anestésicos inalatórios [en]) ou como injeções (intravenosas ou mesmo intramusculares). Todos esses agentes compartilham a propriedade de serem bastante hidrofóbicos (ou seja, como líquidos, não são livremente miscíveis - ou misturáveis - em água e, como gases, dissolvem-se em óleos melhor do que em água).[3][5] É possível administrar a anestesia somente por inalação ou injeção, mas mais comumente as duas formas são combinadas, com uma injeção administrada para induzir a anestesia e um gás usado para mantê-la.[5]
Inalação
[editar | editar código-fonte]
As substâncias anestésicas inalatórias são líquidos ou gases voláteis e geralmente são administradas por meio de um aparelho de anestesia. Um aparelho de anestesia permite a composição de uma mistura de oxigênio, anestésicos e ar ambiente, fornecendo-a ao paciente e monitorando os parâmetros do paciente e do aparelho. Os anestésicos líquidos são vaporizados no aparelho.[5]
Muitos compostos foram usados para anestesia inalatória, mas apenas alguns ainda são amplamente utilizados. O desflurano, o isoflurano e o sevoflurano são os anestésicos voláteis mais usados atualmente. Eles são frequentemente combinados com óxido nitroso. Os anestésicos voláteis mais antigos e menos populares incluem o halotano, o enflurano e o metoxiflurano. Os pesquisadores também estão explorando ativamente o uso do xenônio como anestésico.[5]
Injeção
[editar | editar código-fonte]Os anestésicos injetáveis são usados para a indução e manutenção de um estado de inconsciência. Os anestesistas preferem usar injeções intravenosas, pois elas são mais rápidas, geralmente menos dolorosas e mais confiáveis do que as injeções intramusculares ou subcutâneas. Entre os medicamentos mais usados estão:
- Propofol
- Etomidato
- Barbitúricos, como metohexital e tiopentona/tiopental
- Benzodiazepínicos, como o midazolam
- A cetamina é usada no Reino Unido como "anestesia de campo", por exemplo, em incidentes de trânsito ou situações semelhantes em que uma operação deve ser realizada no local ou quando não há tempo suficiente para ir para uma sala de cirurgia, preferindo outros anestésicos quando as condições permitem seu uso. É usado com mais frequência no ambiente operatório nos EUA.[5]
Os benzodiazepínicos são sedativos e são usados em combinações com outros anestésicos gerais.[2][5]
Mecanismo de ação
[editar | editar código-fonte]A indução e a manutenção da anestesia geral e o controle dos vários efeitos colaterais fisiológicos geralmente são obtidos por meio de uma abordagem combinatória de medicamentos. Os anestésicos gerais individuais variam com relação a seus efeitos fisiológicos e cognitivos específicos. Embora a indução da anestesia geral possa ser facilitada por um anestésico geral, outros podem ser usados em paralelo ou subsequentemente para alcançar e manter o estado anestésico desejado. A abordagem medicamentosa utilizada depende do procedimento e das necessidades dos profissionais de saúde.[2]
Postula-se que os anestésicos gerais exercem sua ação por meio da ativação de receptores inibitórios do sistema nervoso central (SNC) e da inativação de receptores excitatórios do SNC. As funções relativas de diferentes receptores ainda estão sendo debatidas, mas há evidências de que alvos específicos estão envolvidos com determinados anestésicos e efeitos de drogas.[2][6][7]
Abaixo estão vários alvos principais dos anestésicos gerais que provavelmente medeiam seus efeitos.
Agonistas do receptor GABAA
[editar | editar código-fonte]Os receptores GABAA são canais de cloreto que hiperpolarizam os neurônios e funcionam como receptores inibitórios do SNC. Os anestésicos gerais que os agonizam são normalmente usados para induzir um estado de sedação e/ou inconsciência. Esses medicamentos incluem propofol, etomidato, isoflurano, benzodiazepínicos (midazolam, lorazepam, diazepam) e barbitúricos (tiopental sódico, metohexital).[2][3][4]
Antagonistas do receptor NMDA
[editar | editar código-fonte]A cetamina, um antagonista do receptor NMDA, é usada principalmente por seus efeitos analgésicos e, de forma não autorizada, por seus efeitos antidepressivos. No entanto, essa droga também altera a excitação e é frequentemente usada em paralelo com outros anestésicos gerais para ajudar a manter um estado de anestesia geral. A administração isolada de cetamina leva a um estado dissociativo, no qual o paciente pode ter alucinações auditivas e visuais. Além disso, a percepção da dor é dissociada da percepção de estímulos nocivos. A cetamina parece se ligar preferencialmente aos receptores NMDA nos interneurônios GABAérgicos, o que pode explicar parcialmente seus efeitos.[2][3][4]
Ativação de canais de potássio de dois poros (K2Ps)
[editar | editar código-fonte]Os canais de potássio de dois poros (K2Ps) modulam a condutância de potássio que contribui para o potencial de membrana em repouso nos neurônios. A abertura desses canais, portanto, facilita uma corrente hiperpolarizante, que reduz a excitabilidade neuronal. Descobriu-se que os K2Ps são afetados por anestésicos gerais (especialmente anestésicos inalatórios halogenados) e atualmente estão sendo investigados como possíveis alvos. A família de canais K2P compreende seis subfamílias, que incluem 15 membros exclusivos. Treze desses canais (excluindo os homômeros TWIK-1 e TWIK-2) são afetados pelos anestésicos gerais. Embora não tenha sido determinado que os anestésicos gerais se ligam diretamente a esses canais, nem esteja claro como esses medicamentos afetam a condutância do K2P, estudos eletrofisiológicos demonstraram que determinados anestésicos gerais resultam na ativação do canal K2P. Foi demonstrado que essa ativação de canal induzida por drogas depende de aminoácidos específicos em determinados canais K2P (ou seja, canais TREK-1 e TASK). No caso do TREK-1, a ativação foi demonstrada por meio de uma perturbação anestésica nos grupos de lipídios da membrana e na ativação da fosfolipase D2; a ligação direta de anestésicos ao TREK-1 reconstituído purificado não teve efeito sobre a condutância.[8] Os efeitos de certos anestésicos gerais são menos pronunciados em camundongos knock-out K2P, em comparação com seus homólogos do tipo selvagem. Cumulativamente, a TASK-1, a TASK-3 e a TREK-1 são particularmente bem apoiadas por desempenharem uma função na indução da anestesia geral.[3][6][7]
Outros
[editar | editar código-fonte]Os agonistas dos receptores opioides são utilizados principalmente por seus efeitos analgésicos. No entanto, esses medicamentos também podem provocar sedação. Esse efeito é mediado por ações opioides nos receptores opioides e de acetilcolina. Embora esses medicamentos possam levar à diminuição da excitação, eles não provocam perda de consciência. Por esse motivo, eles são frequentemente usados em paralelo com outros anestésicos gerais para ajudar a manter um estado de anestesia geral. Tais drogas incluem morfina, fentanil, hidromorfona e remifentanil.[2][4]
A administração do agonista do receptor α2 adrenérgico dexmedetomidina leva a uma sedação que se assemelha ao sono não REM. Ela é usada em paralelo com outros anestésicos gerais para ajudar a manter um estado de anestesia geral, em uma capacidade off-label. Notavelmente, os pacientes são facilmente despertados desse estado de sono não REM.[2][3][4]
Os antagonistas dos receptores de dopamina têm propriedades sedativas e antieméticas. Anteriormente, eles eram usados em paralelo com opioides para provocar anestesia neuroléptica (catalepsia, analgesia e falta de resposta). Eles não são mais usados nesse contexto, pois os pacientes que sofriam de anestesia neuroléptica frequentemente estavam cientes dos procedimentos médicos que estavam sendo realizados, mas não conseguiam se mover ou expressar emoções. Esses medicamentos incluem o haloperidol e o droperidol.[2]
Estágios da anestesia
[editar | editar código-fonte]Durante a administração de um anestésico, o receptor passa por diferentes estágios de comportamento que, por fim, levam à inconsciência. Esse processo é acelerado com anestésicos intravenosos, tanto que é insignificante considerá-lo durante seu uso. Os quatro estágios da anestesia são descritos usando os sinais de Guedel, que significam a profundidade da anestesia. Esses estágios descrevem os efeitos da anestesia principalmente na cognição, na atividade muscular e na respiração.[4]
Estágio I: Analgesia
[editar | editar código-fonte]O receptor da anestesia sente principalmente analgesia, seguida de amnésia e uma sensação de confusão, passando para o próximo estágio.[4]
Estágio II: Excitação
[editar | editar código-fonte]O estágio II é geralmente caracterizado pelo delírio e confusão do receptor, com amnésia grave. Irregularidades nos padrões de respiração são comuns nesse estágio da anestesia. Náuseas e vômitos também são indicadores do estágio II da anestesia. Às vezes, podem ocorrer luta e pânico como resultado do delírio.[4]
Estágio III: Anestesia cirúrgica
[editar | editar código-fonte]A respiração normal é retomada no início do estágio III. Perto do final do estágio, a respiração cessa completamente. Os indicadores do estágio III da anestesia incluem a perda do reflexo dos cílios e a respiração regular. A profundidade da anestesia no estágio III pode ser avaliada pelo movimento dos olhos e pelo tamanho da pupila.[4]
Estágio IV: Depressão medular
[editar | editar código-fonte]Não ocorre respiração no estágio IV. Isso é logo seguido por insuficiência circulatória e depressão dos centros vasomotores. A morte é comum nesse estágio da anestesia se não houver suporte respiratório e circulatório disponível.[4]
Efeitos colaterais fisiológicos
[editar | editar código-fonte]Além dos efeitos clinicamente vantajosos dos anestésicos gerais, há uma série de outras consequências fisiológicas mediadas por essa classe de medicamentos. Em particular, a redução da pressão arterial pode ser facilitada por uma variedade de mecanismos, incluindo a redução da contratilidade cardíaca e a dilatação da vasculatura. Essa queda na pressão arterial pode ativar um aumento reflexivo na frequência cardíaca, devido a um mecanismo de feedback mediado pelo barorreceptor. Alguns anestésicos, no entanto, interrompem esse reflexo.[3][4]
Pacientes sob anestesia geral correm maior risco de desenvolver hipotermia, pois a vasodilatação mencionada acima aumenta o calor perdido pelo fluxo sanguíneo periférico. De modo geral, esses medicamentos reduzem o limiar da temperatura corporal interna no qual os mecanismos autonômicos de termorregulação são acionados em resposta ao frio (por outro lado, o limiar no qual os mecanismos de termorregulação são acionados em resposta ao calor é normalmente aumentado).[9]
Os anestésicos normalmente afetam a respiração. Os anestésicos inalatórios provocam broncodilatação, aumento da frequência respiratória e redução do volume corrente. O efeito líquido é a diminuição da respiração, que deve ser controlada pelos profissionais de saúde, enquanto o paciente está sob anestesia geral.[4] Os reflexos que funcionam para aliviar as obstruções das vias aéreas também são atenuados (por exemplo, vômito e tosse). Combinado com uma redução no tônus do esfíncter esofágico inferior, que aumenta a frequência de regurgitação, os pacientes são especialmente propensos à asfixia durante a anestesia geral. Os profissionais de saúde monitoram de perto os indivíduos sob anestesia geral e utilizam vários dispositivos, como um tubo endotraqueal, para garantir a segurança do paciente.[3]
Os anestésicos gerais também afetam a zona de gatilho quimiorreceptora e o centro de vômito do tronco cerebral, provocando náusea e vômito após o tratamento.[3]
Farmacocinética
[editar | editar código-fonte]Anestésicos gerais intravenosos
[editar | editar código-fonte]Indução
[editar | editar código-fonte]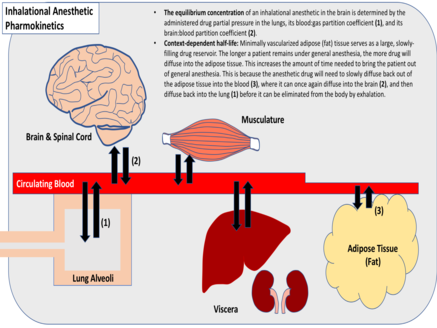
Os anestésicos gerais administrados por via intravenosa são geralmente moléculas pequenas e altamente lipofílicas. Essas características facilitam sua rápida distribuição preferencial no cérebro e na medula espinhal, que são altamente vascularizados e lipofílicos. É nesse local que as ações desses medicamentos levam à indução da anestesia geral.[3]
Eliminação
[editar | editar código-fonte]Após a distribuição no SNC, o fármaco anestésico se difunde do SNC para os músculos e as vísceras, seguido pelos tecidos adiposos. Em pacientes que receberam uma única injeção do medicamento, essa redistribuição resulta no término da anestesia geral. Portanto, após a administração de um único bolus anestésico, a duração do efeito da droga depende exclusivamente da cinética de redistribuição.[3]
A meia-vida de uma droga anestésica após uma infusão prolongada, entretanto, depende da cinética de redistribuição da droga, do metabolismo da droga no fígado e da concentração existente da droga na gordura. Quando grandes quantidades de uma droga anestésica já foram dissolvidas nas reservas de gordura do corpo, isso pode retardar sua redistribuição para fora do cérebro e da medula espinhal, prolongando seus efeitos no SNC. Por esse motivo, diz-se que as meias-vidas desses medicamentos infundidos são dependentes do contexto. Em geral, infusões prolongadas de drogas anestésicas resultam em meias-vidas mais longas, eliminação mais lenta do cérebro e da medula espinhal e atraso no término da anestesia geral.[3]
Anestésicos gerais inalatórios
[editar | editar código-fonte]A concentração alveolar mínima (CAM) é a concentração de um anestésico inalatório nos pulmões que impede que 50% dos pacientes respondam à incisão cirúrgica. Esse valor é usado para comparar as potências de vários anestésicos gerais inalatórios e afeta a pressão parcial do medicamento utilizado pelos profissionais de saúde durante a indução e/ou manutenção da anestesia geral.[3][4]
Indução
[editar | editar código-fonte]A indução da anestesia é facilitada pela difusão de um medicamento anestésico inalado no cérebro e na medula espinhal. A difusão pelo corpo prossegue até que a pressão parcial do fármaco nos vários tecidos seja equivalente à pressão parcial do fármaco nos pulmões.[3] Os profissionais de saúde podem controlar a taxa de indução da anestesia e as concentrações teciduais finais do anestésico variando a pressão parcial do anestésico inspirado. Uma pressão parcial mais alta da droga nos pulmões conduzirá a difusão mais rapidamente por todo o corpo e produzirá uma concentração tecidual máxima mais alta. A frequência respiratória e o volume inspiratório também afetarão a rapidez do início da anestesia, assim como a extensão do fluxo sanguíneo pulmonar.[4]
O coeficiente de partição de um fármaco gasoso é indicativo de sua solubilidade relativa em vários tecidos. Essa métrica é a concentração relativa da droga entre dois tecidos, quando suas pressões parciais são iguais (gás:sangue, gordura:sangue, etc.). Os anestésicos inalatórios variam muito em relação às suas solubilidades teciduais e coeficientes de partição.[3] Os anestésicos altamente solúveis requerem muitas moléculas de droga para aumentar a pressão parcial em um determinado tecido, ao contrário dos anestésicos minimamente solúveis, que requerem relativamente poucas.[4] Em geral, os anestésicos inalatórios minimamente solúveis atingem o equilíbrio mais rapidamente. Os anestésicos inalatórios que têm um alto coeficiente de partição gordura:sangue, no entanto, atingem o equilíbrio mais lentamente, devido à vascularização mínima do tecido adiposo, que serve como um reservatório grande e de enchimento lento para o medicamento.[3]
Eliminação
[editar | editar código-fonte]Os anestésicos inalados são eliminados por meio da expiração, após a difusão nos pulmões. Esse processo depende em grande parte do coeficiente de partição anestésico sangue:gás, da solubilidade do tecido, do fluxo sanguíneo para os pulmões e da frequência respiratória e do volume inspiratório do paciente.[4] Para gases que têm solubilidade mínima no tecido, o término da anestesia geralmente ocorre tão rapidamente quanto o início da anestesia. No entanto, para gases com alta solubilidade tecidual, o término da anestesia geralmente depende do contexto. Assim como ocorre com as infusões intravenosas de anestésicos, a administração prolongada de gases anestésicos altamente solúveis geralmente resulta em meias-vidas mais longas da droga, eliminação mais lenta do cérebro e da medula espinhal e atraso no término da anestesia.[3]
O metabolismo dos anestésicos inalatórios geralmente não é uma via importante de eliminação da droga.[4]
Histórico
[editar | editar código-fonte]Etanol
[editar | editar código-fonte]Embora a maioria das pesquisas se concentre nos efeitos intoxicantes do etanol, ele também pode produzir anestesia geral.[10] Desde a antiguidade, antes do desenvolvimento dos agentes modernos, o álcool era usado como anestésico geral.[11]
Veja também
[editar | editar código-fonte]Referências
[editar | editar código-fonte]- ↑ Franks, Nicholas P. (Maio de 2008). «General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal». Nature Reviews Neuroscience (em inglês). 9 (5): 370–386. ISSN 1471-0048. PMID 18425091. doi:10.1038/nrn2372
- ↑ a b c d e f g h i j Brown, Emery N.; Purdon, Patrick L.; Van Dort, Christa J. (21 de junho de 2011). «General Anesthesia and Altered States of Arousal: A Systems Neuroscience Analysis». Annual Review of Neuroscience. 34 (1): 601–628. ISSN 0147-006X. PMC 3390788
 . PMID 21513454. doi:10.1146/annurev-neuro-060909-153200. hdl:1721.1/86331
. PMID 21513454. doi:10.1146/annurev-neuro-060909-153200. hdl:1721.1/86331
- ↑ a b c d e f g h i j k l m n o p q Goodman & Gilman's pharmacological basis of therapeutics. Goodman, Louis S. (Louis Sanford), 1906-2000., Brunton, Laurence L., Chabner, Bruce., Knollmann, Björn C. 12th ed. New York: McGraw-Hill. 2011. ISBN 9780071624428. OCLC 498979404
- ↑ a b c d e f g h i j k l m n o p q Katzung, Bertram G.; Trevor, Anthony J. (23 de dezembro de 2014). Basic and clinical pharmacology. Katzung, Bertram G., Trevor, Anthony J. Thirteenth ed. New York: [s.n.] ISBN 9780071825054. OCLC 875520239
- ↑ a b c d e f M., Dale, M. (2007). Rang & Dale's pharmacology. Rang, H. P., Dale, Maureen M. 6th ed. [Edinburgh]: Churchill Livingstone. ISBN 978-0443069116. OCLC 76798115
- ↑ a b Franks, Nicholas P (1 de janeiro de 2006). «Molecular targets underlying general anaesthesia». British Journal of Pharmacology (em inglês). 147 (S1): S72–S81. ISSN 1476-5381. PMC 1760740
 . PMID 16402123. doi:10.1038/sj.bjp.0706441
. PMID 16402123. doi:10.1038/sj.bjp.0706441
- ↑ a b Steinberg, E. A.; Wafford, K. A.; Brickley, S. G.; Franks, N. P.; Wisden, W. (1 de maio de 2015). «The role of K2P channels in anaesthesia and sleep». Pflügers Archiv: European Journal of Physiology (em inglês). 467 (5): 907–916. ISSN 0031-6768. PMC 4428837
 . PMID 25482669. doi:10.1007/s00424-014-1654-4
. PMID 25482669. doi:10.1007/s00424-014-1654-4
- ↑ Pavel, Mahmud Arif; Petersen, E. Nicholas; Wang, Hao; Lerner, Richard A.; Hansen, Scott B. (16 de junho de 2020). «Studies on the mechanism of general anesthesia». Proceedings of the National Academy of Sciences. 117 (24): 13757–13766. Bibcode:2020PNAS..11713757P. PMC 7306821
 . PMID 32467161. doi:10.1073/pnas.2004259117
. PMID 32467161. doi:10.1073/pnas.2004259117
- ↑ Bindra, Ashish; Bindu, Barkha; Rath, Girija (1 de julho de 2017). «Temperature management under general anesthesia: Compulsion or option». Journal of Anaesthesiology Clinical Pharmacology (em inglês). 33 (3): 306–316. PMC 5672515
 . PMID 29109627. doi:10.4103/joacp.joacp_334_16
. PMID 29109627. doi:10.4103/joacp.joacp_334_16
- ↑ Wong, SM; Fong, E; Tauck, DL; Kendig, JJ (25 de junho de 1997). «Ethanol as a general anesthetic: actions in spinal cord.». European Journal of Pharmacology. 329 (2–3): 121–7. PMID 9226403. doi:10.1016/S0014-2999(97)89174-1

- ↑ Eger II EI, Saidman LJ, Westhorpe RN (14 de setembro de 2013). The Wondrous Story of Anesthesia. [S.l.]: Springer Science & Business Media. pp. 4–. ISBN 978-1-4614-8441-7. Cópia arquivada em 18 de setembro de 2017
